
| 判断依据 | 结论(写结构简式) |
| 核磁共振氢谱有 个峰 | |
| 核磁共振氢谱有 个峰 |
| m |
| M |
| V |
| Vm |
| m |
| M |
| m |
| M |
| 5.4g |
| 18g/mol |
| 4.4g |
| 44g/mol |
| 5.6L |
| 22.4L/mol |
| 2.8g |
| 28g/mol |
| 1.6g |
| 16g/mol |
| 判断依据 | 结论(写结构简式) |
| 核磁共振氢谱有1个峰 | CH3OCH3 |
| 核磁共振氢谱有3个峰 | CH3CH2OH |


科目:高中化学 来源: 题型:
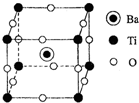 钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.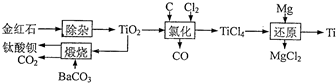
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
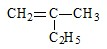
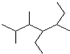 的名称
的名称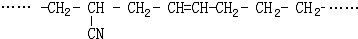 则合成它的单体是
则合成它的单体是查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com