
分析 在Na+浓度为0.3mol•L-1的某无色澄清溶液中,一定不含Cu2+; 取该溶液100mL,先加入足量稀硝酸,放出标准状况下0.224L气体,一定存在碳酸根离子,根据碳元素守恒,物质的量是$\frac{0.224L}{22.4L/mol}$=0.01mol,一定不含Ag+、Ca2+,再加入足量稀Ba (NO3)2溶液,有白色沉淀产生,将混合液过滤洗涤干燥得固体2.33g,所以一定还含有硫酸根离子,根据硫酸根守恒,硫酸根离子的物质的量是$\frac{2.33g}{233g/mol}$=0.01mol,滤液中滴加硝酸银溶液无明显现象,所以一定不含Cl-,根据电荷守恒确定钠离子是否存在即可,硝酸根离子不能确定.
解答 解:在Na+浓度为0.3mol•L-1的某无色澄清溶液中,一定不含Cu2+; 取该溶液100mL,先加入足量稀硝酸,放出标准状况下0.224L气体,一定存在碳酸根离子,根据碳元素守恒,物质的量是$\frac{0.224L}{22.4L/mol}$=0.01mol,一定不含Ag+、Ca2+,再加入足量稀Ba (NO3)2溶液,有白色沉淀产生,将混合液过滤洗涤干燥得固体2.33g,所以一定还含有硫酸根离子,根据硫酸根守恒,硫酸根离子的物质的量是$\frac{2.33g}{233g/mol}$=0.01mol,滤液中滴加硝酸银溶液无明显现象,所以一定不含Cl-,根据电荷守恒:2n(CO32-+)+2n(SO42-)=2×0.01mol+2×0.01mol=0.04mol>n(Na+)=0.03mol,确定钠离子一定存在,硝酸根离子不能确定.
(1)不能确定是否存在的阴离子是NO3-,
故答案为:NO3-;
(2)根据电荷守恒:2n(CO32-+)+2n(SO42-)=2×0.01mol+2×0.01mol=0.04mol>n(Na+)=0.1×0.3mol,因此溶液中一定含有Na+;其浓度至少为0.1mol/L.
故答案为:根据电荷守恒:2n(CO32-+)+2n(SO42-)=2×0.01mol+2×0.01mol=0.04mol>n(Na+)=0.1×0.3mol,因此溶液中一定含有Na+;0.1mol/L.
(3)混合液过滤后洗涤沉淀,检验是否洗净的方法是检验洗涤液中是否含有钡离子即可,即取最后一次洗涤滤液少许于试管,滴加Na2CO3溶液,没有气体,也没有白色沉淀产生,说明已洗净,故答案为:取最后一次洗涤滤液少许于试管,滴加Na2CO3溶液,没有气体,也没有白色沉淀产生,说明已洗净.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,试题侧重考查学生的分析能力及逻辑推理能力,根据溶液电中性判断钾离子的存在情况为易错点.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | V | |||
| X | W |
| A. | 原子半径:X>Y>V>W | |
| B. | X、W的质子数之和与最外层电子数之和的比值为 2:1 | |
| C. | 甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键 | |
| D. | 在足量的沸水中滴入含有16.25 g ZW3的溶液可得到0.1 mol Z(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加盐酸酸化,再加BaCl2溶液 | B. | 加入盐酸酸化的BaCl2溶液 | ||
| C. | 先加BaCl2溶液,再加稀 硝酸 | D. | 加入稀盐酸酸化的Ba(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑧⑨⑪ | B. | ②③④⑥ | C. | ⑦⑩⑫⑪⑭ | D. | ①④⑧⑨⑪⑫ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
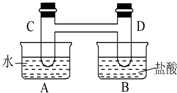 如图所示,在容器A中装有20℃的水50mL,容器B中装有1 mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:
如图所示,在容器A中装有20℃的水50mL,容器B中装有1 mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com