
【题目】t℃时,AgX(X=CI、Br)的溶度积与c(Ag+)和c(X-)的相互关系如图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. AgCl(s)+Br-(aq) →AgBr(s)+CI(aq)平衡常数K=10-4
D. a点AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
【答案】D
【解析】
根据图示,A为氯化银溶液中p(Ag+)与p(Cl-)的关系曲线,线上每一点均为氯化银的饱和溶液,如a点, p(Ag+)=-lgc(Ag+)=5,则c(Ag+)=10-5 mol/L,p(Cl-)= -lgc(Cl-)=5,则c(Cl-)=10-5 mol/L,则Ksp(AgC1)=c(Ag)×c(Cl-)=10-5 mol/L ×10-5 mol/L =10-10,同理Ksp (AgBr) =c(Ag+)c(Br-)=10-7×10-7=10-14。
A、c点,c(Ag+)=10-4mol/L,c(Cl-)=10-4 mol/L,因为10-4×10-4>Kp (AgCl) =10-10, 说明是AgCl的过饱和溶液,选项A错误;
B. b点的AgC1溶液加入AgNO3晶体,c(Ag+)增大,但c(Cl-)基本不变,不能变成a点,选项B错误;
C. t℃时,AgCl(s)+Br-(aq) AgBr(s)+CI(aq)平衡常数K=![]() ,选项C错误;
,选项C错误;
D. t℃时,取a点的AgC1溶液和b点AgBr溶液等体积混合, c(Ag+)=5×10-4 mol/L +![]() 10-7 mol/L
10-7 mol/L![]() 10-4 mol/L,c(Br-)=
10-4 mol/L,c(Br-)=![]() 10-7 mol/L,则c(Ag+) c(Br-)=
10-7 mol/L,则c(Ag+) c(Br-)=![]() 10-4 mol/L×
10-4 mol/L×![]() 10-7 mol/L>10-14,有溴化银沉淀生成,选项D正确。
10-7 mol/L>10-14,有溴化银沉淀生成,选项D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是 )

A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
B. 空气吹出法是工业规模海水提溴的常用方法。其工艺的其中一个环节是把氯气通入酸化的浓缩海水(或苦卤)中。
C. 在工业上一般选用氢氧化钙溶液作为图示中的沉淀剂。
D. 由Mg(OH)2可以制得MgCl2·6H2O,某兴趣小组同学为了制取无水MgCl2,直接加热MgCl2·6H2O即可制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料的合成路线如下所示,请按要求作答:
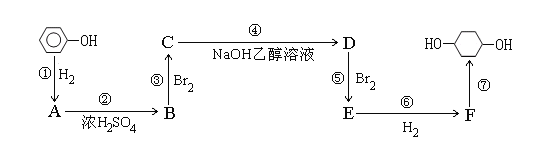
(1)写出以下物质的结构简式:
B ____________________ ; E ______________________;
(2)写出反应④⑦的化学反应方程式:
④ __________________________________________
⑦ ___________________________________________
(3)反应⑤是1:1加成可以得到E,同时可能得到的副产物的结构简式为:
_______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于工业制H2SO4过程中的反应:2SO2(g)+O2![]() 2SO3(g)下列说法错误的是
2SO3(g)下列说法错误的是
A. 使用合适的催化剂可以加快化学反应速率
B. 增大O2浓度可以使SO2转化率达到100%
C. 降温时,反应速率减小
D. 缩小密闭容器的体积,可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,MnCO3、MnS的溶度积分别为2.0×10 -11、5.0×10 -14。下列推断不正确的是 ( )
A. 碳酸锰的溶解度大于硫化锰的溶解度
B. 碳酸锰转化成硫化锰的离子方程式为MnCO3(s)+S2-(aq)![]() MnS(s)+ CO32-(aq)
MnS(s)+ CO32-(aq)
C. 碳酸锰转化成硫化锰的平衡常数K=2.5×10-3
D. 在含相同浓度的CO32一,S2-的溶液中滴加氯化锰溶液,先产生沉淀是MnS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是一种中等活泼金属,化合价为+2价和+3价,其中CoC12易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoC124H2O,其实验装置如下:

①烧瓶中发生反应的离子方程式为______。
②由烧瓶中的溶液制取干燥的CoC124H2O,还需经过的操作有蒸发浓缩、______、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoC124H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdC12溶液能被CO还原为Pd。

①装置E、F是用于检验CO和CO2的,其中盛放PdC12溶液的是装置______(填“E”或“F”)。
②装置G的作用是______;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______。
③通氮气的作用是______。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为__________
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH_______0(填“>”、“<”或“=”,下同)

②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ_____________KⅡ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com