
| A、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | ||||
B、向铜作电极电解硫酸溶液:2H2O
| ||||
| C、向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | ||||
| D、向AlCl3溶液中加入过量的Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ |
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200℃左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )
美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200℃左右供电.电池总反应为:C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是( )| A、a极为电池的正极 |
| B、电池工作时电流由a极沿导线经灯泡再到b极 |
| C、电池正极的电极反应为:4H++O2+4e-═2H2O |
| D、电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| B、向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ |
| C、向某溶液中滴加少量氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ |
| D、向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
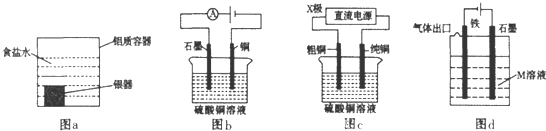
| A、利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2- |
| B、图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C、图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D、图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小容器体积,平衡不移动 |
| B、加入催化剂,B的转化率增大 |
| C、增大c(A),A的转化率增大 |
| D、降低温度,v正增大,v逆减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 仔细观察下面两种电池的构造示意图,完成下列问题:
仔细观察下面两种电池的构造示意图,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸 |
| B、制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性 |
| C、检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡 |
| D、使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com