
(20分)PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)在一个密闭容器中,发生反应:C(s)+H2O(g)  CO(g)+H2(g)则该反应正向反应是: 反应(填:放热、吸热),该反应化学平衡常数表达式为K= ,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向 反应方向移动,v(正) (填:不变、变大、变小)。
CO(g)+H2(g)则该反应正向反应是: 反应(填:放热、吸热),该反应化学平衡常数表达式为K= ,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向 反应方向移动,v(正) (填:不变、变大、变小)。
(2)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇(CH3OH)。
①已知在常温常压下:2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ?H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ?H = -566.0 kJ/mol
H2O(g)=H2O(1) ?H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从 (填“c”或“b”)口通入,电池负极反应式为_______________________________。

(3)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g) ΔH<0 若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是______________。

(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,0.5分钟后达到平衡,测得容器中含SO3 0.18mol,则v(O2)=________mol/(L?min),若继续通入0.20mo1SO2和0.lmolO2,则达平衡时SO2的转化率_______(填“不变”、“增大”“减小”)
(5)25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
(1)吸热 K=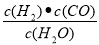 逆 增大
逆 增大
(2) ①CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ·mol-1 ②c CH3OH+ H2O-6e-=CO2↑+6H+
(3)b d (4)0.036 增大 1×10-5
【解析】
试题分析:(1)碳和水蒸气的反应是吸热反应,该反应化学平衡常数表达式为K=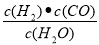 ,达到平衡后,若减小密闭容器的容积,保持温度不变,即增大压强,平衡向系数减小的方向移动,原化学平衡向逆反应方向移动,v(正)增大。
,达到平衡后,若减小密闭容器的容积,保持温度不变,即增大压强,平衡向系数减小的方向移动,原化学平衡向逆反应方向移动,v(正)增大。
(2)①根据盖斯定律①-②-③×4得到CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ·mol-1②结合图像电池中质子移向正极,O2在正极反应,应从c通入,发生O2+4e-+4H+=2H2O,所以负极为CH3OH+ H2O-6e-=CO2↑+6H+;
(3)达到平衡状态时v(正)=v(逆),各物质的量不再改变,a、v(正)应该不在改变,错误。B、各物质的量不再改变,不再有能量变化,温度不变平衡常数不变,正确。c、各物质的量不再改变,错误。可知d、各物质的量不再改变,质量分数不变,正确,选bd;
(4)SO3 0.18mol,则转化的O2为0.09mol,v(O2)=0.09/(5×0.5)= 0.036mol/(L?min), 若继续通入0.20mo1SO2和0.lmolO2,相当于增大压强,平衡正向移动,则达平衡时SO2的转化率增大;
(5)NH3·H2O的电离平衡常数约为=(10-3×10-3)/(10-1-10-3)= 1.0×10-5。
考点:考查影响平衡的因素,盖斯定律应用、燃料电池、电解质溶液、化学平衡等知识。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2014-2015福建省福州市高一上学期期中化学试卷(解析版) 题型:选择题
下列有关化学基本概念与划分依据的联系正确的是
A.氧化还原反应与非氧化还原反应:反应前后元素化合价是否变化
B.纯净物与混合物:是否仅含有一种元素
C.强电解质与弱电解质:溶液的导电能力大小
D.溶液与胶体:能否发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:实验题
某校化学实验兴趣小组欲采用如图所示的实验装置制Cl2,同时进行与氯气有关的某些实验,按要求回答问题。

(1)药品A的名称是 ,此反应的离子方程式是 。
(2)甲同学用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下) 1.12 L(填“大于”“等于”“ 小于”)。
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则气流方向是:
气体F→ → → → (填代号)。


 (4)把净化后的氯气通入如下图装置。
(4)把净化后的氯气通入如下图装置。

①观察到a不褪色,b褪色,可得到的结论是: ;②检验吸收Cl2后的NaOH溶液中含有Cl-时,需要滴加的试剂以及现象为 。
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图)。

能说明Cl2的氧化性强于I2的实验现象是: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列物质不能通过化合反应直接制得的是
A.NaCl B.Al(OH)3 C.FeCl2 D.CO
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:选择题
通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是
A.硝酸钠 氢氧化钠 B.氧化铜 二氧化锰
C.氯化钾 碳酸钙 D.硫酸铜 氢氧化钠
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期末考试化学试卷(解析版) 题型:选择题
在一定温度下发生反应:I2(g)+H2(g) 2HI(g);△H<0并达平衡。
2HI(g);△H<0并达平衡。

HI的体积分数ω(HI)随时间变化如图曲线(II)所示。若改变反应条件,HI的体积分数ω(HI)变化曲线如图所示,则(I)和(III)改变的条件分别是
①恒容条件下,升高温度 ②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当的催化剂
A.①⑤,③ B.②⑤,④ C.③⑤,② D.③⑤,④
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列事实一定能证明HNO2是弱电解质的是
①常温下HNO2溶液的pH小于7 ②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应 ④0.1 mol/L HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2 ⑥pH=1的 HNO2溶液稀释至100倍,pH约为2.8
⑦常温下NaNO2溶液的pH大于7
A.①④⑥ B.①②③④ C.④⑤⑥⑦ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省高二上学期期中化学试卷(解析版) 题型:推断题
(16分)已知一个碳原子连两个—OH的结构不稳定,会很快脱去一分子水,其变化如下:
 →
→  + H2O
+ H2O
下图中B和 、
、 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。

(1)A的化学名称为___ _
(2)第④步的化学方程式为__________,该反应类型为_____;
(3)第⑦步的化学方程式为__________,该反应类型为_____;
(4)E的结构简式为______;
(5)符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢的C的同分异构体的结构简式分别是 、 、 。
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
证明某溶液只含有Fe2+而不含有Fe3+的实验方法是
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
D.只需滴加KSCN溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com