选择适宜的材料和试剂设计一个原电池,完成下列反应:Zn+CuSO4=ZnSO4+Cu
(1)画出装置图(要求在图上标出电极材料和电解质溶液)
(2)写出电极反应式:正极: ;负极: .
(3)描述电极上的实验现象:正极: ;负极 .
【答案】
分析:利用反应Zn+CuSO
4=ZnSO
4+Cu设计原电池时,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如Cu等,也可以是碳棒,电解质溶液应为CuSO
4,工作时,正极反应式为Cu
2++2e
-=Cu,有红色金属析出,负极反应式为Zn-2e-=Zn
2+,Zn棒逐渐溶解.
解答:解:(1)利用反应Zn+CuSO
4=ZnSO
4+Cu设计原电池时,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如Cu等,也可以是碳棒,电解质溶液应为CuSO
4,故答案为:
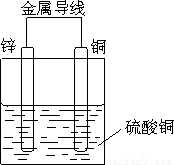
;
(2)工作时,正极反应式为Cu
2++2e
-=Cu,负极反应式为Zn-2e-=Zn
2+,故答案为:Cu
2++2e
-=Cu;Zn-2e-=Zn
2+;
(3)正极发生还原反应,生成红色金属铜,负极发生氧化反应,锌逐渐溶解,故答案为:有红色金属析出;Zn棒逐渐溶解;
点评:本题考查原电池的设计和工作原理,题目难度不大,注意把握原电池的组成和原理,注重基础知识的积累.

 ;
;

 53随堂测系列答案
53随堂测系列答案
