
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
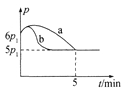
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。
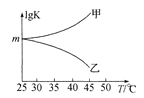
②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。
【答案】K3=![]() 289-2a 2 4. 0×10-8 L·mol-1·s-1 acd < 加入催化剂 乙 2
289-2a 2 4. 0×10-8 L·mol-1·s-1 acd < 加入催化剂 乙 2
【解析】
(1)利用方程式叠加关系得到平衡常数之间的关系;
(2)利用键能计算焓变,反应物的键能之和减去生成物的键能之和就是焓变;
(3)将表中数据带入速率方程即可求得n和k;
(4)平衡状态的判定;
(5)列三段式计算平衡常数,进而去计算。
(1)①![]() ②
②![]() 将①×2②可得:
将①×2②可得:![]() ,则平衡常数
,则平衡常数![]() ,
,
故答案为:![]() ;
;
(2)![]() 反应的△H=反应物的键能之和生成物的键能之和
反应的△H=反应物的键能之和生成物的键能之和![]() ,
,
故答案为:289-2a;
(3)根据表格①②中的数据,带入速率公式然后做比值:![]() ,解得n=2,将n代入①中得k=4×108,
,解得n=2,将n代入①中得k=4×108,
故答案为:2;4. 0×10-8 L·mol-1·s-1;
(4)a.对于反应![]() ,反应前后气体系数变化,故压强是变量,故当压强不再变化说明反应已经平衡,a正确;
,反应前后气体系数变化,故压强是变量,故当压强不再变化说明反应已经平衡,a正确;
b. 2v正(NO) = v逆(Cl2),正逆反应速率不相等,反应未达到平衡状态,b错误;
c. 气体的平均相对分子质量即平均摩尔质量等于总质量比总物质的量,总质量虽然不变,但是总物质的量会改变,故平均相对分子质量是变量,当它不再变化则说明反应已经达到平衡状态,c正确;
d. 绝热容器中,温度会改变,温度改变平衡常数就会改变,当平衡常数不再变化则说明反应已经达到平衡状态,d正确;
e.![]() 和
和![]() 的体积比始终是2:1,不是变量,故不能说明达到平衡状态,e错误;
的体积比始终是2:1,不是变量,故不能说明达到平衡状态,e错误;
答案选acd;
(5)①由图甲分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随反应进行温度升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变为△H<0;由图甲知:化学反应速率加快,平衡不动,故改变的条件:加入催化剂;
答案为:<;加入催化剂;
②T升高,平衡左移,K减小,lgK减小,曲线选乙,设反应的氯气物质的量为x,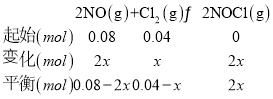 根据压强之比等于物质的量之比,得到:
根据压强之比等于物质的量之比,得到:![]() ,解得:x=0.02mol,依据计算得到平衡时物质的浓度代入x求得:
,解得:x=0.02mol,依据计算得到平衡时物质的浓度代入x求得:![]() ;
;![]() ;
;![]() ;
;
平衡常数: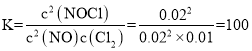 ,lgK=lg100=2,m=2;
,lgK=lg100=2,m=2;
故答案为:乙;2。/span>


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为![]()
B. 常温常压下,8 g O2含有的电子数是4NA
C. 标准状况下,2.24 L CCl4中含有的分子数为0.1NA
D. 25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g) + O2(g) △H >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A.500 s内NO2的生成速率为2.96×10-3mol·L-1·s-1
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)﹤5.00mol/L
D.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各对物质,互为同系物的是( )
A. CH3CH2C1与CH3CHCl﹣CH2ClB. CH3COOH与CH3CH2COOCH3
C. 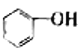 与
与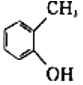 D.
D. ![]() 与
与![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
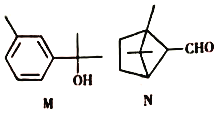
A. M和N互为同分异构体
B. M分子中所有碳原子均处于同一平面上
C. N与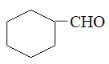 属于同系物
属于同系物
D. M和N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4℃时在100mL水中溶解了22.4L氯化氢气体(在标准状况下测得)。下列关于所形成的溶液说法中,正确的是( )
A. 该溶液溶质的物质的量浓度为10mol·L-1
B. 若已知该溶液的密度,则可求得溶液溶质的物质的量浓度
C. 该溶液中含有0.1mol的Cl-
D. 该溶液的体积为22.5L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增加,且均不大于20。
的原子序数依次增加,且均不大于20。![]() 、
、![]() 、
、![]() 族序数之和为10;
族序数之和为10;![]() 的原子半径在同周期主族元素中最小;
的原子半径在同周期主族元素中最小;![]() 与
与![]() 形成的化合物常温下可与饱和
形成的化合物常温下可与饱和![]() 溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
A.简单离子半径:![]()
B.![]() 的单质是人类将太阳能转化为电能的常用材料
的单质是人类将太阳能转化为电能的常用材料
C.![]() 与
与![]() 形成的化合物均满足8电子稳定结构
形成的化合物均满足8电子稳定结构
D.![]() 与
与![]() 形成的化合物与饱和
形成的化合物与饱和![]() 溶液的反应可选用启普发生器
溶液的反应可选用启普发生器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
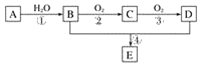
图1
(1)写出下列物质的官能团名称:
B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。
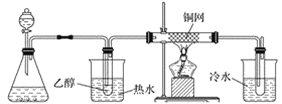
甲 乙 丙 丁
图2
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A Na2O2 B KCl C Na2CO3 D MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为1∶2的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A.①②③ B.①②④ C.②③④ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com