
| A. | I、Br、Cl | B. | Al、P、Si | C. | O、S、Na | D. | N、C、B |
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL)] | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
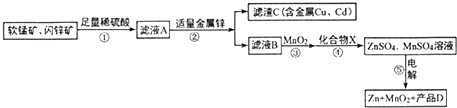
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
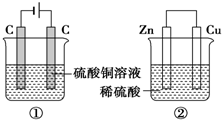 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与HCN反应引入:
与HCN反应引入: $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$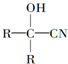
 $→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D
$→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D ,D
,D .
.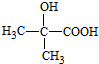 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
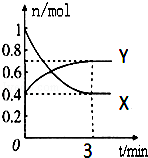 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期主族元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com