
| 选项 | A | B | C | D |
| 实验操作 | 向MgCl2、AlCl3溶液中(各1mol),逐滴加入NaOH溶液 | 向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1mol),逐滴加入NaOH溶液 | 向NaOH、NaAlO2溶液中(各1mol),逐滴加入HCl溶液 | 向NaOH、Na2CO3混合溶液中(各1mol)滴加稀盐酸 |
| 图象 | 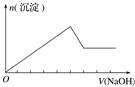 |  | 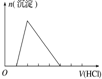 | 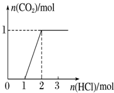 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向MgCl2、AlCl3溶液中(各1mol),逐滴加入NaOH溶液,开始有白色沉淀生成,后来沉淀部分消失;
B.向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1mol),逐滴加入NaOH溶液,加1molNaOH时无现象,加6molNaOH时沉淀达到最大值,再加1molNaOH,沉淀值不变;
C. 向NaOH、NaAlO2溶液中(各1mol),逐滴加入HCl溶液,开始时,无现象,后来有白色沉淀,最后沉淀又完全消失;
D.向NaOH、Na2CO3混合溶液中(各1mol)滴加稀盐酸,开始时与NaOH反应,然后HCl与碳酸钠反应,最后HCl与碳酸氢钠反应.
解答 解:A.向MgCl2、AlCl3溶液中(各1mol),逐滴加入NaOH溶液,开始有白色沉淀生成,加5molNaOH时,沉淀达到最大值,再加1molNaOH,沉淀减少1mol,图象符合,故A不选;
B.向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1mol),逐滴加入NaOH溶液,加1molNaOH时HCl与NaOH溶液反应,无现象,当加6molNaOH时沉淀达到最大值,再加1molNaOH,NaOH与铵根离子反应,沉淀值不变,又加1molNaOH时,与氢氧化铝沉淀反应,沉淀减少1mol,图象符合,故B不选;
C. 向NaOH、NaAlO2溶液中(各1mol),逐滴加入HCl溶液,开始时NaOH与HCl反应,无现象,加2molHCl时,生成氢氧化铝沉淀,再加3molHCl,沉淀又完全消失,图象符合,故C不选;
D.向NaOH、Na2CO3混合溶液中(各1mol)滴加稀盐酸,开始时1molHCl与1molNaOH反应,然后1molHCl与1mol碳酸钠反应生成碳酸氢钠,所以加2molHCl时没有气体生成,再加1molHCl,恰好与碳酸氢钠反应生成二氧化碳气体,图象不符,故D选.
故选D.
点评 本题考查铝的化合物的性质,解决本题的关键是明确每阶段发生的反应,侧重考查学生分析计算能力和读图能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 标准状况下22.4LCCl4含有C-Cl键的数目为4NA | |
| B. | 电解精炼铜时,若转移的电子数为NA个,则阳极减小质量为32g | |
| C. | 电解旅58.5g熔融NaCl,标准状况能产生22.4L氯气、23.0g金属钠 | |
| D. | 己知N2(g)+3H2(g)=2NH3(g)△H=-40.3kJ•mol-1,则在相同条件下通入6molH2和2molN2进行该反应时放出热量小于80.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe3+ | |
| C. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+3Na+ | |
| D. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol•L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内NO2的生成速率为2.96×10-3 mol•L-1•s-1 | |
| B. | T1温度下该反应平衡时N2O5的转化率为29.6% | |
| C. | 达到平衡其他条件不变,将容器的体积压缩到原来1/2,则c(N2O5)<5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g Na 与足量H2O反应完全后可生成nA个H2分子 | |
| B. | 1 mol乙烯分子含有2nA碳碳双键 | |
| C. | 标况下,22.4LN2和H2混合气中含nA个原子 | |
| D. | 标况下,22.4LCl2与足量Fe和Cu混合物点燃,反应后,转移的电子数为2nA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
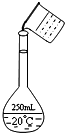 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1mol Na2O2与足量水反应后产生氧气,理论上转移的电子数为2×6.02×1023 | |
| B. | 0.1mol/L Na2CO3溶液加热后,溶液的pH减小 | |
| C. | 室温下稀释0.1mol/L CH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小 | |
| D. | 向废水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
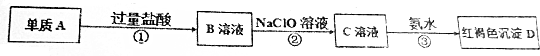
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.02mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(N2)=0.01mol/(L•min) | D. | v(H2)=0.015mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com