
����Ŀ��ʵ�����û�������ˮ�ķ����ϳɻ���ϩ����ʵ���װ������ͼ��ʾ��
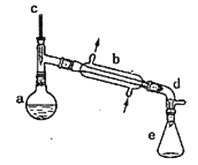
�����õ����й��������£�
��Է������� | �ܶȣ�(g��cm-3) | �е㣯�� | �ܽ��� | |
���Ѵ� | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
������ʵ�鲽��ش����⣺
��������ϳ�
��a�м���10.0g��������2Ƭ���Ƭ����ȴ��������������1mLŨ���ᣬb��ͨ����ȴˮ��ʼ��������a�������������¶Ƚӽ�90����
��l�����Ƭ��������________��b��������________��
��2��a�з�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ____________________________����ʵ�������ײ������л�������Ľṹ��ʽΪ________��
���������ᴿ
����Ӧ�ֲ��ﵹ���Һ©���У�����������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������X�õ������Ļ���ϩ��������������Ϊ4.1g��
��3����̼������Һϴ�ӵ�������________������X������Ϊ________��
����������������ʼ���
��4���ٺ˴Ź��������������������Ƿ�Ϊ����ϩ������ϩ��������_______�ֲ�ͬ��ѧ��������ԭ�ӡ�
�� ��ʵ�����û���ϩ�IJ�����_______��
���𰸡� ��ֹa��Һ�屩�� ֱ�������� ![]()
![]() ��ȥ�ֲ�Ʒ�е����� ���� 3 50%
��ȥ�ֲ�Ʒ�е����� ���� 3 50%
��������(l)���Ƭ�Ĵ��ڿ��Է�ֹ�ڼ��ȹ����в�����������������b��������ֱ����������
(2)��Ũ������������£����Ȼ���������ȡ����ϩ����Ӧ�Ļ�ѧ����ʽΪ��![]() �����ȹ����У����������ɷ�����ȥ��Ӧ���ɻ���ϩ�⣬�����Է���ȡ����Ӧ�����Ӽ䷢����ˮ��Ӧ���ɶ������ѣ�������Ľṹ��ʽΪ
�����ȹ����У����������ɷ�����ȥ��Ӧ���ɻ���ϩ�⣬�����Է���ȡ����Ӧ�����Ӽ䷢����ˮ��Ӧ���ɶ������ѣ�������Ľṹ��ʽΪ![]() ��
��
(3)����̼�����ܺ����ᷴӦ���ɿ�����ˮ�������ƣ�ϴ������̼������Һ��ȥ�ֲ�Ʒ�е��������X��Ŀ���Ƿ�������ܵ�Һ�������X������Ϊ����
(4)�ٻ���ϩ�ǶԳƽṹ�����������3�ֲ�ͬ��ѧ��������ԭ����
�ڻ����������ʵ���Ϊ![]() =0.1mol�������Ͽ��Եõ�0.1mol����ϩ��������Ϊ8.2g�����Բ���=
=0.1mol�������Ͽ��Եõ�0.1mol����ϩ��������Ϊ8.2g�����Բ���=![]() ��100%=50%��
��100%=50%��


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ���У��������ڿ������������е���
A. PM2��5 B. CO2 C. SO2 D. NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��Ӧ2H2��g��+O2��g���T2H2O��g���������仯ʾ��ͼ������˵����ȷ���ǣ� ��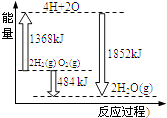
A.�÷�Ӧ�����ȷ�Ӧ����
B.��2molH2��1molO2���4molH��2molOԭ����Ҫ�ų�����
C.2molH2��g����1molO2��g����Ӧ����2molH2O��g�������ų�484kJ����
D.4molH��2molO����2molH2O��g�������ų�484kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ����dz�����ˮ����������ҵ���Ʊ���ˮFeCl3��һ�ֹ�����ͼ�� 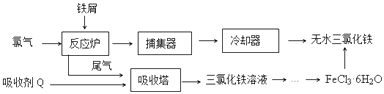
��1����FeCl36H2O�����Ʊ���ˮFeCl3Ӧ��ȡ�Ĵ�ʩ�ǣ� ��
��2����ˮ���Ȼ�����ˮ�е��ܽ�����£�
�¶�/�� | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
�ܽ�ȣ�g/100gH2O�� | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
��FeCl3��Һ�Ƶ�FeCl36H2O����IJ��������ǣ������������ᡢ�������ˡ�ϴ�ӡ����
��3�������£�����Һ��pH���Ʋ�����ʹFe3+������pH=4ʱ����Һ��c��Fe3+��=molL��1 �� ��������Ksp[Fe��OH��3]=2.6��10��39��
��4��FeCl3����������ͨ�����õ������ⶨ����ȡ2.300g��ˮ�Ȼ�����Ʒ������ϡ���ᣬ��ת�Ƶ�100mL����ƿ��������ˮ���ݣ�ȡ��10.00mL�������Թ�����KI��Һ����ַ�Ӧ����ijһָʾ������0.1000molL��1Na2S2O3��Һ�ζ���ȥ12.50mL��
��֪��I2+2S2O32��=2I��+S4O62��
��д�������Թ�����KI��Һ��Ӧ�����ӷ���ʽ��
������Ʒ���Ȼ���������������д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ʵ���������һ�ֻ�����Һ�������˳���Һ���Ի��ǡ������ʵ��װ�÷���©�����û��ˮ����ֽҲδ���������С©���������ʵ��ʧ��ԭ����������в����е�
A����ֽ�߳�©����Ե�IJ���δ����
B����ֽ��©��֮��������δ���ŵ�
C���㵹Һ��ʱҺ�������ֽ��Ե
D������ʱ����������һ����ֽһ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ƣ�Na2S2O5���dz��õĿ����������ڿ����С�����ʱ���ֽ⣮ʵ�����Ʊ�����Na2S2O5�ķ������ڲ��Ͻ����£����Ʒ�Ӧ�¶���40�����ң���Na2CO3��������Һ��ͨ��SO2 �� ʵ��װ����ͼ��ʾ�� 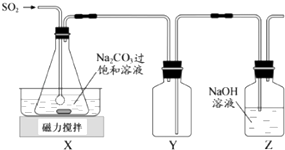
����ҺpHԼΪ4ʱ��ֹͣ��Ӧ����20�����Ҿ��ýᾧ������Na2S2O5�Ļ�ѧ����ʽΪ��2NaHSO3�TNa2S2O5+H2O
��1��SO2��Na2CO3��Һ��Ӧ����NaHSO3��CO2 �� �����ӷ���ʽΪ ��
��2��װ��Y��������
��3����������ķ�ӦҺ����ѹ���ˡ�ϴ�ӡ�25�橁30�����ɻ��Na2S2O5���壮
����ɼ�ѹ����װ�õ���Ҫ�����Dz���©�����ͳ����ã�
�������ñ���SO2ˮ��Һ����ˮ�Ҵ�ϴ��Na2S2O5���壮�ñ���SO2ˮ��Һϴ�ӵ�Ŀ���� ��
��4��ʵ���Ƶõ�Na2S2O5�����к���һ������Na2SO3��Na2SO4 �� ����ܵ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���� A��Ħ������Ϊ28g/mol���й�A��ת����ϵ��ͼ��ʾ����ش��������⣺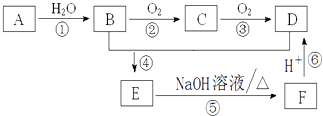
��1��C���������ŵ����ƣ� �� �ٵķ�Ӧ����Ϊ�� ��
��2��E�Ľṹ��ʽΪ�� ��
��3��B��C�Ļ�ѧ����ʽΪ�� ��
��4��E��F�Ļ�ѧ����ʽΪ�� �� ��Ӧ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ����������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ��ǣ� ��
A.NH3 ![]() NO
NO ![]() NaNO2
NaNO2
B.Fe2O3 ![]() Fe
Fe ![]() FeCl3
FeCl3
C.SiO2 ![]() H2SiO3��aq��
H2SiO3��aq�� ![]() Na2SiO3
Na2SiO3
D.CuCl2��aq�� ![]() Cu��OH��2
Cu��OH��2 ![]() Cu2O
Cu2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(CoOC2O3)��;�㷺��һ������ˮ�ܿ�[��Ҫ�ɷ�ΪCo2O3����������Fe2O3��Al2O3��MgO��MnO��CaO��]��ȡCoC2O4��2H2O�Ĺ����������£�
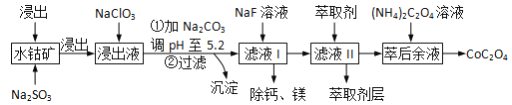
��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��1�����������м���Na2SO3�������ǽ�__________��ԭ�������ӷ��ţ����ò���Ӧ�����ӷ���ʽΪ_________��
��2��NaClO3�������ǽ�����Һ�е�Fe2+������Fe3+ ����Ԫ�ر���ԭΪ��ͼۡ��÷�Ӧ�����ӷ���ʽΪ_______________��
��3����Na2CO3��ʹ����Һ��Fe3+��Al3+ת�����������������ԭ���ǣ������ӷ���ʽ��ʾ��д������һ�����ɣ�_____________��
��4����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ����ͼ��ʾ��ʹ����ȡ�����˵�pH=________������ţ����ҡ�
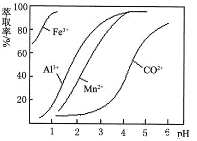
A��2.0 B��3.0 C��4.0
��5����ҺI�����ƣ�þ���ǽ���Һ��Ca2+��Mg2+ת��ΪMgF2��CaF2��������֪Ksp(MgF2)=7.35��10-11��Ksp(CaF2)=1.05��10-10�����������NaF��������Һc(Mg2+)/c(Ca2+)=_____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com