
| A、20 mL,3mol.L-1 |
| B、20 mL,2mol.L-1 |
| C、10 mL,4mol.L-1 |
| D、10 mL,2mol.L-1 |


科目:高中化学 来源: 题型:
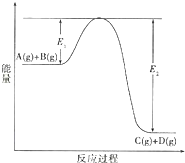 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
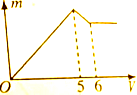 向Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液时,其沉淀的质量m和所加NaOH体积V之间的关系如图所示,则混合液中Al2(SO4)3与MgSO4的物质的量之比是( )
向Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液时,其沉淀的质量m和所加NaOH体积V之间的关系如图所示,则混合液中Al2(SO4)3与MgSO4的物质的量之比是( )| A、1:1 | B、1:2 |
| C、2:1 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 上海世博会上澳大利亚馆的外墙采用的是特 殊的耐风化钢覆层材料,外墙的颜色每天都在发生着变化,它会随空气中太阳、风雨、湿度的影响,逐渐结出一层锈斑,从橙色到赭红色的转变,看上去外观的生锈程度在增加,运用了钢材生锈原理.下列有关钢材生锈的说法正确的是( )
上海世博会上澳大利亚馆的外墙采用的是特 殊的耐风化钢覆层材料,外墙的颜色每天都在发生着变化,它会随空气中太阳、风雨、湿度的影响,逐渐结出一层锈斑,从橙色到赭红色的转变,看上去外观的生锈程度在增加,运用了钢材生锈原理.下列有关钢材生锈的说法正确的是( )| A、红色铁锈的主要成分是Fe(OH)3 |
| B、钢材在空气中的变化只有氧化还原反应 |
| C、空气中太阳、风雨、湿度对钢材的腐蚀有影响 |
| D、钢材在空气中的腐蚀主要为电化学腐蚀,其负极的反应为:Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
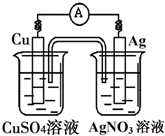 已知反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )
已知反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池.下列说法中正确的是( )| A、铜电极是正极,其电极反应为Cu-2e-=Cu2+ |
| B、银电极上发生还原反应,电极质量增加 |
| C、当铜电极质量减少0.64g时,电解质溶液中有0.02mol电子通过 |
| D、外电路中电子由银电极流向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分解反应一定是氧化还原反应 |
| B、非金属单质在氧化还原反应中一定作氧化剂 |
| C、氧化剂具有氧化性,还原剂具有还原性 |
| D、氧化剂在氧化还原反应中被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com