
”¾ĢāÄæ”ææÕĘųĪŪČ¾ĪļNOĶس£ÓĆŗ¬Ce4+µÄČÜŅŗĪüŹÕ£¬Éś³ÉHNO2”¢NO3-£¬ŌŁĄūÓƵē½ā·Ø½«ÉĻŹöĪüŹÕŅŗÖŠµÄHNO2×Ŗ»ÆĪŖĪŽ¶¾ĪļÖŹ£¬Ķ¬Ź±Éś³ÉCe4+£¬ĘäŌĄķČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
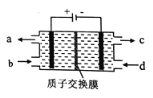
A. H+ÓÉ×óŹŅ½ųČėÓŅŹŅ
B. Ce4+“Óµē½ā²ŪµÄcæŚĮ÷³ö£¬ĒŅæÉŃ»·Ź¹ÓĆ
C. Ņõ¼«µÄµē¼«·“Ó¦Ź½:2HNO2+6H+-6e-=N2”ü+4H2O
D. ČōÓĆ¼×ĶéČ¼ĮĻµē³Ų×÷ĪŖµēŌ“£¬µ±Ļūŗıź×¼×“æöĻĀ33.6L¼×Ķ鏱£¬ĄķĀŪÉĻæÉ×Ŗ»Æ2molHNO2
”¾“š°ø”æA
”¾½āĪö”æµē½ā³ŲÖŠÓėµēŌ“Õż¼«ĻąĮ¬µÄµē¼«ŹĒŃō¼«£¬·¢ÉśŹ§Č„µē×ÓµÄŃõ»Æ·“Ó¦£¬ÓėµēŌ“øŗ¼«ĻąĮ¬µÄµē¼«ŹĒŅõ¼«£¬·¢ÉśµĆµ½µē×ӵĻ¹Ō·“Ó¦£¬¾Ż“Ė½ā“š”£
A”¢×ó²ąµē¼«ŹĒŃō¼«£¬µē½ā³ŲÖŠŃōĄė×ÓĻņŅõ¼«ŅĘ¶Æ£¬øł¾Żµē½āŌĄķ£¬H£«ÓÉ×óŹŅĻņÓŅŹŅŅĘ¶Æ£¬AÕżČ·£»
B”¢æÕĘųĪŪČ¾ĪļNOĶس£ÓĆŗ¬Ce4£«ČÜŅŗĪüŹÕ£¬Éś³ÉHNO2”¢NO3££¬NµÄ»ÆŗĻ¼ŪÉżøߣ¬Ce4£«µÄ»ÆŗĻ¼Ū½µµĶ£¬Č»ŗó¶Ō“ĖČÜŅŗ½ųŠŠµē½ā£¬ÓÖ²śÉśCe4£«£¬øł¾Żµē½āŌĄķ£¬Ó¦ŌŚŃō¼«ÉĻ²śÉś£¬¼“Ce4£«“ÓaæŚĮ÷³ö£¬æÉŃ»·Ź¹ÓĆ£¬B“ķĪó£»
C”¢øł¾Żµē½āŌĄķ£¬Ņõ¼«ÉĻµĆµē×Ó£¬»ÆŗĻ¼Ū½µµĶ£¬HNO2×Ŗ»ÆĪŖĪŽ¶¾ĪļÖŹ£¬¼“×Ŗ»ÆĪŖN2£¬Ņõ¼«µē¼«·“Ó¦Ź½ĪŖ2HNO2£«6H£«£«6e£=N2”ü£«4H2O£¬C“ķĪó£»
D”¢±źæöĻĀ33.6L¼×ĶéµÄĪļÖŹµÄĮæŹĒ1.5mol£¬²ĪÓė·“Ó¦×ŖŅʵē×ÓĪļÖŹµÄĮæĪŖ1.5mol”Į8=12mol£¬1molŃĒĻõĖįµĆµ½3molµē×Ó£¬Ņņ“ĖĄķĀŪÉĻæÉ×Ŗ»ÆHNO2µÄĪļÖŹµÄĮæĪŖ12mol”Ā3=4mol£¬D“ķĪó”£
“š°øŃ”A”£


 ÓŵČÉśĢāæāĻµĮŠ“š°ø
ÓŵČÉśĢāæāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”涞Įņ»Æīā(MoS2)±»ÓžĪŖ”°¹ĢĢåČ󻬼ĮÖ®Ķõ”±£¬ĄūÓƵĶĘ·ÖŹµÄ»Ōīāæó(ŗ¬MoS2”¢SiO2ŅŌ¼°CuFeS2µČŌÓÖŹ) Öʱøøߓ涞Įņ»ÆīāµÄŅ»ÖÖÉś²ś¹¤ŅÕČēĻĀ:

»Ų“šĻĀĮŠĪŹĢā:
£Ø1£©īāĖįļ§µÄ»ÆѧŹ½ĪŖ(NH4)2MoO4£¬ĘäÖŠMoµÄ»ÆŗĻ¼ŪĪŖ______”£
£Ø2£©ĄūÓĆĮŖŗĻ½ž³ö³żŌÓŹ±£¬Ēā·śĖįæɳżČ„µÄŌÓÖŹ»ÆѧŹ½ĪŖ______£¬ČēøÄÓĆFeCl3ČÜŅŗŃõ»Æ½ž³ö£¬CuFeS2ŌÓÖŹµÄ½ž³öŠ§¹ūøüŗĆ£¬Š“³öŃõ»Æ½ž³öŹ±·¢ÉśµÄ»Æѧ·“Ó¦·½³ĢŹ½______________”£
£Ø3£©¼ÓČėNa2Sŗó£¬īāĖįļ§×Ŗ»ÆĪŖĮņ“śīāĖįļ§[(NH4)2MoS4]£¬Š“³ö(NH4)2MoS4ÓėŃĪĖįÉś³ÉMoS3³ĮµķµÄĄė×Ó·“Ó¦·½³ĢŹ½_______________________”£
£Ø4£©ÓÉĻĀĶ¼·ÖĪö²śÉśČżĮņ»Æīā³ĮµķµÄĮ÷³Ģ֊ӦєŌńµÄ×īÓÅĪĀ¶ČŗĶŹ±¼äŹĒ________________”£

ĄūÓĆ»ÆŃ§Ę½ŗāŅʶÆŌĄķ·ÖĪöµĶÓŚ»ņøßÓŚ×īÓÅĪĀ¶ČŹ±£¬MoS3µÄ²śĀŹ¾łĻĀ½µµÄŌŅņ:_______________________”£
£Ø5£©MoO3”¤H2O×÷ĪŖøßÄÜ·ĒĖ®ĢåĻµµē³ŲµÄÕż¼«²ÄĮĻÓÅÓŚŅ»°ćŠĀŠĶ²ÄĮĻ£¬Ä³µē³Ų·“Ó¦ĪŖ: MoO3”¤H2O+xA=AxMoO3”¤H2O (ijĪÄĻ×¼ĒŌŲ:Ź½ÖŠ0+ĪŖLi+”¢H+”¢K+”¢Na+µČ”£A+µÄ×¢ČėŹ¹µĆ²æ·ÖMo6+»¹ŌĪŖMO5+),Š“³öøƵē³ŲŅŌ½šŹōļ®ĪŖøŗ¼«£¬³äµēŹ±µÄŃō¼«·“Ó¦Ź½:__________________”£
£Ø6£©ŅŃÖŖKsp(BaSO4)=1.1”Į10-10£¬Ksp(BaMoO4)=4.0”Į10-8)īāĖįÄĘ¾§Ģå(NaMoO4”¤2H20)ŹĒŠĀŠĶµÄ½šŹō»ŗŹ“¼Į£¬²»“æµÄīāĖįÄĘČÜŅŗÖŠČōŗ¬ÉŁĮææÉČÜŠŌĮņĖįŃĪŌÓÖŹ£¬æɼÓČėBa(OH)2¹ĢĢå³żČ„SO42-(ČÜŅŗĢå»ż±ä»ÆŗöĀŌ)£¬Ōņµ±BaMo04æŖŹ¼³ĮµķŹ±£¬ČÜŅŗÖŠµÄc(MoO42-)/c(SO42-)____(½Y¹ū±£Įō2Ī»ÓŠŠ§Źż×Ö)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚĶ¼ÖŠÄĘ¼°Ęä»ÆŗĻĪļ×Ŗ»ÆµÄŠšŹöÖŠ£¬²»ÕżČ·µÄŹĒ £Ø £©

A. ¢ŁĪŖ»ÆŗĻ·“Ó¦ B. ¢ŚĪŖÖĆ»»·“Ó¦
C. ¢ŪŃõ»Æ»¹Ō·“Ó¦ D. ¢ÜĪŖ·ĒŃõ»Æ»¹Ō·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼ÖŠ¼×”ŖĪģ·Ö±šĪŖĻĀŹöĪåÖÖĪļÖŹÖŠµÄŅ»ÖÖ£ŗCuSO4”¢H2SO4”¢Fe”¢Na2CO3ŗĶCa(OH)2£¬ĒŅĶ¼ÖŠĻąĮ¬Į½øö»·¶ŌÓ¦µÄĪļÖŹ£Ø»ņĘäČÜŅŗ£©ŌŚ³£ĪĀĢõ¼žĻĀÄÜ·¢Éś»Æѧ·“Ó¦”£

£Ø1£©ÉĻŹöĪåÖÖĪļÖŹÖŠ£ŗ
¢ŁæÉÓĆÓŚÅ©ŅµÉś²śøÄĮ¼ĖįŠŌĶĮČĄµÄŹĒ_________________”£
¢ŚÄÜĻą»„·¢ÉśÖĆ»»·“Ó¦µÄŅ»øö»Æѧ·½³ĢŹ½ĪŖ_________________________”£
£Ø2£©ČōĶ¼ÖŠŅŅĪŖH2SO4£ŗ
¢Ł¼×»ņ±ūÄÜ·ńĪŖCuSO4£æ“š£ŗ_____________£ØĢī”°æÉŅŌ”±»ņ”°²»æÉŅŌ”±£©”£
¢ŚČōŅŅÓė¶”·¢ÉśÖŠŗĶ·“Ó¦£¬Ōņ±ūĪŖ_________________”£
£Ø3£©Čō±ūĪŖĢś£¬Ōņ¼×ÓėĪģ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫22.4gĢś·ŪÖš½„¼ÓČėµ½ŗ¬HNO3 0.8molµÄĻ”ĻõĖįÖŠ£¬·“Ӧɜ³ÉµÄĘųĢåµÄĪļÖŹµÄĮæ£Øx£©ĖęĻūŗÄĢś·ŪµÄĪļÖŹµÄĮæ£Øy£©±ä»Æ¹ŲĻµÖŠÕżČ·µÄŹĒ£Ø””””£©
A.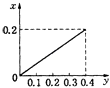
B.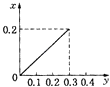
C.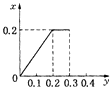
D.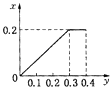
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆPt×÷µē¼«µē½āMgCl2ČÜŅŗ,ĻĀĮŠ¹ŲÓŚµē½ā×°ÖĆÕżČ·µÄŹĒ£Ø £©
A. ×Ü·“Ó¦Ź½£ŗMg+2H2O= Mg(OH) 2”ż+H2”ü
B. øŗ¼«·“Ó¦Ź½£ŗMg2+-2e-= Mg
C. ×Ü·“Ó¦Ź½£ŗMg+2H2O= Mg(OH) 2+H2”ü
D. Ņõ¼«µē¼«·“Ó¦Ź½£ŗ2H++2e-= H2”ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25 ”ꏱ£¬½«pH£½2µÄĒæĖįČÜŅŗÓėpH£½13µÄĒæ¼īČÜŅŗ»ģŗĻ£¬ĖłµĆ»ģŗĻŅŗµÄpH£½11£¬ŌņĒæĖįČÜŅŗÓėĒæ¼īČÜŅŗµÄĢå»ż±ČŹĒ(ŗöĀŌ»ģŗĻŗóČÜŅŗµÄĢå»ż±ä»Æ)
A. 11”Ć1 B. 9”Ć1 C. 1”Ć11 D. 1”Ć9
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijӊ»śĪļ·Ö×ÓÖŠÓŠ n øöCH 2 £¬ m øö ![]() £¬aøöCH 3 £¬ ĘäÓąĪŖOH£¬ŌņøĆĪļÖŹ·Ö×ÓÖŠOHµÄøöŹżæÉÄÜĪŖ£Ø””””£©
£¬aøöCH 3 £¬ ĘäÓąĪŖOH£¬ŌņøĆĪļÖŹ·Ö×ÓÖŠOHµÄøöŹżæÉÄÜĪŖ£Ø””””£©
A.m©a
B.n+m+a
C.m+1©a
D.m+2©a
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢśŌŚÉś²śÉś»īÖŠÓ¦ÓĆ×ī¹ć·ŗ£¬Į¶Ģś¼¼ŹõŗĶŗ¬ĢśŠĀ²ÄĮĻµÄÓ¦ÓƱ¶ŹÜ¹Ų×¢”£
(1)øßĀÆĮ¶ĢśŹĒŅ±Į¶ĢśµÄÖ÷ŅŖ·½·Ø£¬·¢ÉśµÄÖ÷ŅŖ·“Ó¦ÓŠ:
·“Ó¦ | ”÷H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
ŹŌ¼ĘĖć£¬X=_____£¬K1”¢K2ÓėK3Ö®¼äµÄ¹ŲĻµĪŖ____________”£
(2)T1”ꏱ,ĻņijŗćĪĀĆܱÕČŻĘ÷ÖŠ¼ÓČėŅ»¶ØĮæµÄFe2O3ŗĶC£¬·¢Éś·“Ó¦i£¬·“Ó¦“ļµ½Ę½ŗāŗó£¬ŌŚt1Ź±æĢ,øıäijĢõ¼ž,V(Äę)Ėꏱ¼ä(t)µÄ±ä»Æ¹ŲĻµČēĶ¼1ĖłŹ¾£¬Ōņt1Ź±æĢøıäµÄĢõ¼žæÉÄÜŹĒ_____(ĢīŠ“×ÖÄø)”£
a.±£³ÖĪĀ¶Č²»±ä,Ń¹ĖõČŻĘ÷ b.±£³ÖĢå»ż²»±ä£¬ÉżøßĪĀ¶Č
c.±£³ÖĢå»ż²»±ä,¼ÓÉŁĮæĢ¼·Ū d.±£³ÖĢå»ż²»±ä,Ōö“óCOÅضČ
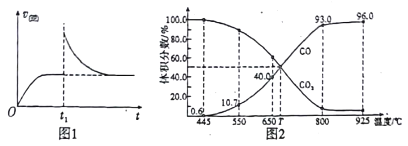
(3)ŌŚŅ»¶ØĪĀ¶ČĻĀ£¬ĻņijĢå»żæɱäµÄŗćŃ¹ĆܱÕČŻĘ÷(p×Ü)¼ÓČė1molCO2 Óė×ćĮæµÄĢ¼£¬·¢Éś·“Ó¦¢££¬Ę½ŗāŹ±ĢåĻµÖŠĘųĢåĢå»ż·ÖŹżÓėĪĀ¶ČµÄ¹ŲĻµČēĶ¼2 ĖłŹ¾”£
¢Ł650”ꏱ,øĆ·“Ó¦“ļĘ½ŗāŗóĪüŹÕµÄČČĮæŹĒ______”£(¼ĘĖ揱²»æ¼ĀĒĪĀ¶Č¶Ō”÷HµÄÓ°Ļģ)
¢ŚT”ꏱ,ČōĻņĘ½ŗāĢåĻµÖŠŌŁ³äČėŅ»¶ØĮæ°“V(CO2):V(CO) =5:4µÄ»ģŗĻĘųĢå£¬Ę½ŗā_____(Ģī”° ÕżĻņ”±”¢”° ÄęĻņ”±»ņ”° ²»”± )ŅĘ¶Æ”£
¢Ū925”ꏱ,ÓĆĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č±ķŹ¾µÄ»ÆŃ§Ę½ŗā³£ŹżKpĪŖ_____”£[ĘųĢå·ÖŃ¹(p·Ö)=ĘųĢå×ÜŃ¹(p×Ü) ”ĮĢå»ż·ÖŹż£¬ÓĆijĪļÖŹµÄĘ½ŗā·ÖŃ¹“śĢęĪļÖŹµÄĮæÅضČŅ²æÉŅŌ±ķŹ¾»ÆŃ§Ę½ŗā³£Źż£¬¼Ē×÷Kp]
(4)ÓĆŌµē³ŲŌĄķæÉŅŌ³żČ„ĖįŠŌ·ĻĖ®ÖŠµÄČżĀČŅŅĻ©”¢AsO3-£¬ĘäŌĄķČēĶ¼3ĖłŹ¾( µ¼µēæĒÄŚ²æĪŖÄÉĆ×Įć¼ŪĢś)”£
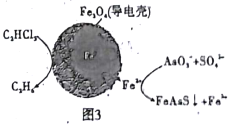
ŌŚ³żĪŪ¹ż³ĢÖŠ£¬ÄÉĆ×Įć¼ŪĢśÖŠµÄFeĪŖŌµē³ŲµÄ______¼« (Ģī”°Õż"»ņ”°øŗ”±)£¬Š“³öC2HCl3ŌŚĘä±ķĆę±»»¹ŌĪŖŅŅĶéµÄµē¼«·“Ó¦Ź½ĪŖ_____________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com