
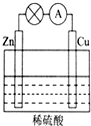
 (1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
(1)如图所示的原电池装置中,其负极材料是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑,原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.分析 (1)根据锌比铜活泼,所以锌作负极,氢离子在正极Cu上得电子生成氢气,根据消耗的金属的量计算生成气体的量;
(2)根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,得电子化合价降低的反应物为正极、失电子化合价升高的金属为负极;
放电时,H2SO4参加反应导致溶液中c( H+)降低;放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;电流从正极沿导线流向负极.
解答 解:(1)由于锌比铜活泼,所以锌作负极,所以消耗的金属为锌.
锌失电子生成锌离子进入溶液,电极反应式为锌片:Zn-2e-=Zn2+,铜片上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑,
总反应:Zn+2H+=H2↑+Zn2+
65g 2g
6.5g Xg
$\frac{65}{6.5}$=$\frac{2}{X}$
解得X为0.2g.
故答案为:Zn;铜片表面产生无色气泡; 2H++2e-=H2↑;0.2;
(2)根据电池反应式知,Pb元素化合价由0价、+4价变为+2价,失电子化合价升高的金属为负极,则Pb为负极,放电时,H2SO4参加反应导致溶液中c( H+)降低,则溶液pH增大、酸性减小,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,电流从正极PbO2沿导线流向负极Pb,故答案为:Pb;减小;负;负;正.
点评 本题考查了原电池原理,明确正负极上发生反应及元素化合价变化即可解答,知道电流方向、电解质溶液中阴阳离子移动方向等知识点,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量样品于试管中,滴加适量的1mol?L-1H2SO4溶液,加热溶解,得到A溶液 | |
| 步骤2: | 若高锰酸钾溶液紫红色褪去,则样品中含+2价的铁元素 |
| 步骤3: | 若溶液变红色,则样品中含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,则混合后溶液中一定有:c(X-)=c(Y+)>c(H+)=c(OH-) | |
| B. | 若m+n=14,则混合后溶液一定显中性 | |
| C. | 若混合后溶液中c(X-)<c(Y+),则该混合溶液一定显碱性 | |
| D. | 若a=b,混合后溶液pH<7,则混合溶液中一定存在:c(Y-)=c(X-)+c(HX) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸的pH=3,则1.0×10-8mol/L盐酸的pH=8 | |
| D. | 某温度下水的离子积为1×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同浓度的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,铵根浓度大小关系为(NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl | |
| B. | 向AgCl悬浊液中滴入KI溶液有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 | |
| C. | 0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2 溶液混合后,溶液的pH=1 | |
| D. | 0.2 mol/L的NaHCO3溶液中c(H+)+c(Na+)═c(CO32-)+c(OH-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热水瓶胆中的水垢可以用食醋除去 | |
| B. | 福尔马林用于标本的制作是利用了使蛋白质变性的性质 | |
| C. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| D. | 在清理厕所时洁厕灵和84消毒液不能混用,否则可能发生中毒现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com