

 .
. ,
,分析 由元素在周期表中位置,可知a为H,b为C、c为N、d为O、e为Na、f为Al、g为Si、h为P、i为S、j为Cl、k为Cl.
(1)元素的金属性越强,其对应最高价氧化物的水化物碱性越强,氢氧化钠为离子化合物,含有O-H极性共价键,氨气中存在三对N-H共价键;
(2)Na2O2是离子化合物,由Na+离子和O2-离子构成;
(3)氢氧化铝为两性氢氧化物,与强碱反应;
(4)KOH溶液为电解液的氢氧燃料电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,结合电极反应解答该题;
(5)由于O与H易形成氢键,故水的沸点在同族氢化物中最高;
(6)双氧水在催化剂二氧化锰和氯化铁的催化下容易分解为水和氧气;
(7)由C和H形成的化合物为烃,据此解答即可.
解答 解:由于金属性Na最强,那么NaOH的碱性最强,氢氧化钠中存在钠离子和氢氧根离子,即存在共价键和离子键,NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,故答案为:NaOH;离子键、共价键;
,故答案为:NaOH;离子键、共价键; ;
;
(2)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: ;
;
(3)难溶物和氧化物不能拆,氢氧化铝与氢氧化钠反应的离子反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)通入氧气的电极为正极,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,电解质溶液中溶质不变,溶剂的量增大,所以氢氧化钾的物质的量浓度变小,溶液的pH减小,n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据化合价可知转移电子0.2mol,故答案为:O2+2H2O+4e-=4OH-;变小;0.2NA;
(6)双氧水容易分解为氧气和水,常利用的催化剂是二氧化锰和氯化铁,故选AB;
(7)a为H元素,b为C元素,形成的化合物中C的质量分数为$\frac{6}{7}$,且其相对分子质量在30~50之间,设化学式为CxHy,则$\left\{\begin{array}{l}{12x+y>30}\\{12x+y<50}\\{\frac{12x}{12x+y}=\frac{6}{7}}\end{array}\right.$,解x=3,y=6,故二者形成的分子式为C3H6,故答案为:C3H6.
点评 本题考查元素周期表与元素周期律、无机物推断、常用化学用语等,难度中等,注意对元素周期律的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性Ca(HCO3)2的缘故 | |
| B. | 长期盛放NaOH溶液的试剂瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气体减少形成负压的缘故 | |
| C. | 严格地讲,实验室使用”通风橱”防污染是不负责任的,因为实验产生的有害气体没有得到转化或吸收 | |
| D. | “雨后彩虹”与“海市蜃楼”都是自然界的光学现象,也与胶体知识有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
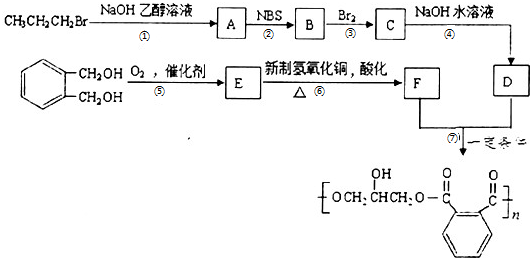
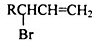
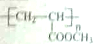 ,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,请设计合成路线(无机试剂及溶剂任选).注:合成路线的书写格式参照如下示例流程图:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成 ②球棍模型为: 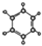 |
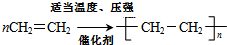 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)(红棕色)?N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 | |
| B. | 对于N2(g)+3H2(g)?2NH3(g),平衡后,保持压强不变,充入Ar,平衡左移 | |
| C. | FeCl3+3KSCN?Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl固体,因为平衡向逆反应方向移动,故体系颜色变浅 | |
| D. | H2(g)+I2(g)?2HI(g)△H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,LiMn2O4发生氧化反应,电池内部Li+向正极移动 | |
| B. | 放电时,正极反应为:Li++LiMn2O4+e-═Li2Mn2O4 | |
| C. | 醋酸可用作锂离子电池的电解质 | |
| D. | 充电时,锂的碳材料为阳极且反应为:Li++e-═Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应:O2+4e-+2H2O=4OH- | |
| B. | 负极反应:2C4H10+26CO32--52e-=34CO2+10H2O | |
| C. | 为了使燃料电池长时间稳定运行,电池的电解质组成应保持稳定,故须在通入的空气中加入CO2 | |
| D. | 电解质熔液中的CO32-从正极迁移到负极,而内电路中的电流流向则从负极迁移到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com