
 .
. 分析 (1)①CO中C与O以三键结合在一起;价电子数相同、原子数相同的微粒为互为等电子体;
②根据相似相溶原理分析;
(2)根据核外电子排布式的书写规则书写;根据价电子排布判断电离能的大小;
(3)根据价层电子对互斥理论来判断;
(4)①Fe(CO)5常温下呈液态,熔沸点较低,应为分子晶体;
②CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4.
解答 解:(1)①CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则CO的结构式为C≡O,等电子体中原子数和价电子数都相同,则 N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,
故答案为:C≡O;CN-;
②Ni(CO)4中Ni采取SP3杂化,是正四面体结构,所以属于非极性分子,根据相似相溶原理,非极性溶质易溶于非极性溶剂,苯和四氯化碳是非极性分子,所以Ni(CO)4易溶于苯和四氯化碳,
故答案为:bc;
(2)镓是31号元素,该原子核外有31个电子,4S能级能量小于3d能级能量,根据能量最低原理,电子先排4s能级后排3d能级,所以铜的核外电子排布式为1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,价电子中3d、4s轨道为全充满状态,原子较稳定,故Zn的第一电离能大于Ga,
故答案为:1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga;
(3)H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=$\frac{6+1×2}{2}$=4,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{3+1×3}{2}$=3,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形.
故选:d;
(4)①Fe(CO)5常温下呈液态,熔沸点较低,易溶于非极性溶剂,应为分子晶体,
故答案为:分子晶体;
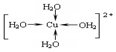
②CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4.水合铜离子的结构简式为 .
.
故答案为: .
.
点评 本题综合性较强,涉及分子的结构、晶体与化学键、核外电子排布规律、杂化类型的判断、配位键等,题目难度中等,是对所学知识及学生能力的综合考查.注意分子立体构型以及杂化类型的判断,为物质结构与性质模块的考查热点.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
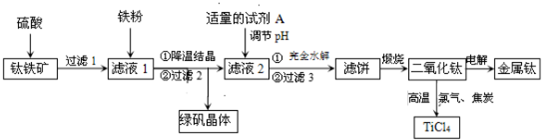
查看答案和解析>>
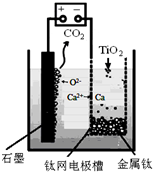
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的密度小 | B. | 铝表面能形成致密的氧化膜 | ||
| C. | 常温下铝不能与氧气反应 | D. | 铝的化学性质不活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ K+ SO42- AlO2- | B. | Ca2+ Na+ SO42- Cl- | ||
| C. | Na+ K+ SO42- NO3- | D. | K+ Na+ MnO4- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
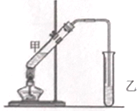 酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题:
酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com