
 由Cu、Zn、稀H2S04形成如下图甲、乙装置.试回答以下问題:
由Cu、Zn、稀H2S04形成如下图甲、乙装置.试回答以下问題:分析 (1)根据原电池的构成条件来回答;锌铜、稀硫酸构成的原电池中,锌易失电子发生氧化反应而作负极,铜作正极,电子从负极沿导线流向正极,电流流向与电子流向正好相反,正极上氢离子得电子发生还原反应,据此回答;
(2)锌易失电子发生氧化反应而作负极,铜作正极,发生还原反应,据此回答;
(3)负极上锌生成锌离子进入溶液而导致质量减少,正极上氢离子得电子生成氢气,所以正极质量不变,两个电极减少的质量是锌的质量,根据锌和氢气之间的关系式计算生成氢气的体积.
解答 解:(1)A.不能构成回路,所以甲不是原电池,故A错误;
B.甲不是原电池,铜片表面不能出现气体,乙装置中铜片是正极,表面均有气泡产生,故B错误;
C.两烧杯中溶液中的氢离子均被消耗,所以溶液的pH均增大,故C正确;
D.乙装置形成原电池,会加快反应速率,所以产生气泡的速率甲中比乙中慢,故D正确;
E.乙装置形成原电池,外电路中电流从正极流向负极,即电流方向Zn←Cu,故E错误.
故答案为:CD;
(2)乙装置形成原电池,金属锌是负极,发生失电子的氧化反应,即Zn-2e-=Zn2+,铜是正极,发生的电子的还原反应,即2H++2e-=H2↑,
故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;
(3)负极上锌生成锌离子进入溶液而导致质量减少,正极上氢离子得电子生成氢气,所以正极质量不变,两个电极减少的质量是锌的质量,锌和稀硫酸反应离子方程式为2H++Zn=Zn2++H2↑,根据锌和氢气之间的关系式得氢气的体积=$\frac{\frac{60g-47g}{65g/mol}}{1}$=4.48L,
故答案为:4.48L.
点评 本题考查原电池的工作原理,题目难度不大,注意两极电极反应转移的电子数目相等是计算的关键.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
 已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | Cl-Cl |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 243 |
| A. | 表中最稳定的共价键是Si-Si | |
| B. | Cl2(g)→2 Cl(g):△H=-243 kJ•mol | |
| C. | H2 (g)+Cl2(g)=2HCl(g):△H=-183 kJ•mol | |
| D. | 根据表中数据能计算出SiCl4(g)+2 H2(g)=Si(s)+4 HCl(1)的△H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烯烃与氢气加成得2,2-二甲基丁烷,该烯烃是2,2-二甲基-1-丁烯 | |
| B. | 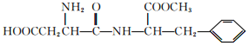 能发生水解反应,且与酸、碱均能反应 能发生水解反应,且与酸、碱均能反应 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 为检验某卤代烃中的卤素原子,应取少量卤代烃于试管中加入氢氧化钠溶液煮沸,冷却后加硝酸银溶液,然后根据卤化银沉淀的颜色确定卤素原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①③④⑤⑧ | C. | ①②③④⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W | V |
| 原子半径/nm | 0.090 | 0.118 | 0.075 | 0.073 | 0.102 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 | +6、-2 |
| A. | X、Z、W位于同周期,Y与V位于同周期 | |
| B. | Y3+与V2-的核外电子数相等 | |
| C. | Y与W形成的化合物具有两性 | |
| D. | Z的氢化物可与V的最高价氧化物的水溶液反应生成盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com