
【题目】柠檬酸结构简式为:
(1)柠檬酸中的官能团有、______(写名称)。
(2)1mol柠檬酸最多可消耗NaOH的物质的量是______mol。
(3)下列关于柠檬酸的说法正确的是______ (填序号)。
A 可发生酯化反应
B 可发生加成反应
C 可发生消去反应
D 其分子式是C6H8O6
科目:高中化学 来源: 题型:
【题目】工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH<0,将0.3 mol SiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
Si3N4(s)+12HCl(g) ΔH<0,将0.3 mol SiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:

下列说法正确的是( )
A.250 ℃,前2 min, Si3N4 的平均反应速率为0.02 mol·L-1·min-1
B.反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C.达到平衡前,300 ℃条件的反应速率比250 ℃快; 平衡后,300 ℃比250 ℃慢
D.反应达到平衡时, 两种条件下反应放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是

A. C、D、E 的氢化物的稳定性:C>D>E
B. 元素 A 的原子最外层轨道中无自旋状态相同的电子
C. 元素 C、D 之间不可能形成化合物
D. 与元素 B 同周期且第一电离能最小的元素的单质能与 H2O 发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种高效安全消毒剂,常温下
是一种高效安全消毒剂,常温下![]() 为红黄色有刺激性气味气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水但不与水反应,遇热水缓慢水解。某研究性学习小组欲制备
为红黄色有刺激性气味气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水但不与水反应,遇热水缓慢水解。某研究性学习小组欲制备![]() 水溶液并检验其性质。
水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。

在圆底烧瓶中先放入![]() 固体和
固体和![]() ,然后再加入5mL稀硫酸,用磁力搅拌棒搅拌(如图),将烧瓶放在热水浴中,保持60℃~80℃,至B中广口瓶内呈深红黄色时停止加热。回答下列问题:
,然后再加入5mL稀硫酸,用磁力搅拌棒搅拌(如图),将烧瓶放在热水浴中,保持60℃~80℃,至B中广口瓶内呈深红黄色时停止加热。回答下列问题:
(1)装置A用水浴加热的优点是_________;装置A中水浴温度不低于60℃,其原因是_______________。
(2)装置A中反应生成![]() 及
及![]() 等产物的化学方程式为_____________________;
等产物的化学方程式为_____________________;
(3)装置B的水中需放入冰块的目的是__________________;已知![]() 缓慢水解生成的含氯化合物只有
缓慢水解生成的含氯化合物只有![]() 和
和![]() ,且物质的量之比为2:1,则该反应的化学方程式为____________;装置C中的
,且物质的量之比为2:1,则该反应的化学方程式为____________;装置C中的![]() 溶液吸收尾气中的
溶液吸收尾气中的![]() ,生成物质的量之比为的1:1的两种盐,一种为
,生成物质的量之比为的1:1的两种盐,一种为![]() ,另一种为_________________。
,另一种为_________________。
Ⅱ.![]() 的含量测定
的含量测定
步骤1:量取![]() 溶液
溶液![]() ,稀释成
,稀释成![]() 试样;量取
试样;量取![]() 试样加入到锥形瓶中;
试样加入到锥形瓶中;
步骤2:调节试样的![]() ,加入足量的
,加入足量的![]() 晶体,振荡后,静置片刻;
晶体,振荡后,静置片刻;
步骤3:加入指示剂,用![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。
。
(4)已知:![]() ,
,![]() ,原
,原![]() 溶液的浓度为_____
溶液的浓度为_____![]() (用含字母的代数式表示),如果滴定速度过慢,会使计算出的数值______(填“偏大”、“偏小”或“不变”)。
(用含字母的代数式表示),如果滴定速度过慢,会使计算出的数值______(填“偏大”、“偏小”或“不变”)。
Ⅲ.设计实验验证![]() 的氧化性
的氧化性
(5)取适量![]() 水溶液加入
水溶液加入![]() 溶液中,振荡,得无色溶液。欲检验
溶液中,振荡,得无色溶液。欲检验![]() 的氧化产物,还需要用到的试剂是____________。
的氧化产物,还需要用到的试剂是____________。
(6)证明![]() 的氧化性比
的氧化性比![]() 强的方案是__________________________________。
强的方案是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的以下五种元素:
X | 单质与水反应生成的气体可使带火星的木条复燃 |
Y | 核外有三个能级,毎个能级的电子数相等 |
Z | 最外层电子数是次外层的3倍 |
W | 在元素周期表中处于第8列 |
R | 核外电子占据9个轨道,有2个未成对电子 |
Q | 第二周期中单电子数最多 |
(1)X元素名称_____________,RZ3中R的杂化方式为_____________。
(2)W原子结构示意图为_____________,,Y、Z、Q电负性由小到大顺序_____________。(用元素符号表示)
(3)将Q氢化物浓溶液中加入Cu粉,并通入Z2,充分反应后溶液呈深蓝色,该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:R-CH=CH-O-R′![]() R-CH2CHO + R′OH
R-CH2CHO + R′OH
(烃基烯基醚)
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
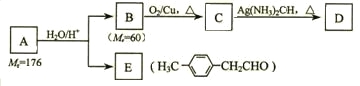
请回答下列问题:
⑴ A的分子式为_________________。
⑵ B的名称是__________;A的结构简式为_______________。
⑶写出C → D反应的化学方程式:_____________________________。
⑷写出两种同时符合下列条件的E的同分异构体的结构简式:
①属于芳香醛; ②苯环上有两种不同环境的氢原子。
_________________________、________________________。
Ⅱ.由E转化为对甲基苯乙炔(![]() )的一条路线如下:
)的一条路线如下:

⑸写出G的结构简式:___________________________。
⑹写出①-④步反应所加试剂、反应条件和①-③步反应类型:____________
序号 | 所加试剂及反应条件 | 反应类型 |
① | ||
② | ||
③ | ||
④ | —— |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3g3He含有的中子数为1NA
B.48g正丁烷和10g异丁烷的混合物中共价键数目为13NA
C.在标准状况下,22.4LNH3被O2完全氧化为NO时,转移电子的数目为5NA
D.一定条件下,6.4g铜与过量的硫反应,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是

A. A、B两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液的酸性弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如下:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂①的量应________,验证MgSO4已完全转化为Mg(OH)2的方法是____________________。
(2)加入试剂①,能够分离得到Mg(OH)2沉淀的方法是_______________。
(3)试剂②可以选用____________,反应的离子方程式为__________________________。
(4)无水MgCl2在熔融状态下,通电后会得到Mg和Cl2,写出该反应的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com