
【题目】某课外活动小组为探究金属与浓硫酸反应,进行了如下实验。
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示。(固定装置已略去)
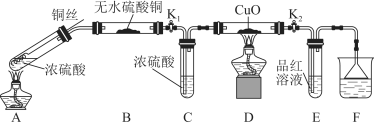
(1)A中反应的化学方程式为 。
(2)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是 。
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(3)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是__________________;
(4)某同学用下列装置连接成一整套实验装置以验证(3)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________________(用a、b……填写)。
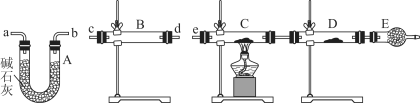
(5)根据(4)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:

①___________________________________________________________________________
②___________________________________________________________________________
③___________________________________________________________________________
④___________________________________________________________________________
⑤___________________________________________________________________________
【答案】
(1)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)D装置中黑色固体颜色无变化,E中溶液褪色
(3)氢气和水蒸气
(4)cd(或dc)ab(或ba)e
(5)①无水硫酸铜②固体由白色变成蓝色③SO2中含有水蒸气④固体由黑色变成红色⑤SO2中含有氢气
【解析】
试题分析:(1)碳和浓硫酸在加热条件下生成二氧化碳、二氧化硫和水,反应的化学方程式为:2H2SO4(浓)+Cu ![]() SO2↑+SO42-+Cu2++2H2O。
SO2↑+SO42-+Cu2++2H2O。
故答案为:2H2SO4(浓)+Cu![]() SO2↑+SO42-+Cu2++2H2O;
SO2↑+SO42-+Cu2++2H2O;
(2)由于D装置中黑色固体颜色无变化,E中溶液褪色,说明反应生成了二氧化硫,证明反应中S元素被还原,在反应中作氧化剂,而氢离子没有被还原,所以浓硫酸的中S的氧化性大于氢离子。
故答案为:D装置中黑色固体颜色无变化,E中溶液褪色;
(3)随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO2中的杂质可能为H2和H2O(g)。
故答案为:氢气和水蒸气;
(4)先检验水的存在,将水除尽,再检验H2和CuO反应生成的水,B装置检验水,A装置除去气体中的水蒸气,C、D用于检验气体中是否含有H2,所以气流方向为:c d(或d c)a b(或b a)e。
故答案为:c d(或d c)a b(或b a)e;
(5)B装置检验水,装置内盛放无水硫酸铜,若固体由白色变成蓝色,说明SO2中含有水蒸气;
若含有H2,在装置C中发生反应H2+CuO![]() Cu+H2O,固体由黑色变成红色,D装置内固体由白色变成蓝色,说明SO2中含有氢气。
Cu+H2O,固体由黑色变成红色,D装置内固体由白色变成蓝色,说明SO2中含有氢气。
故答案为:①无水硫酸铜;②固体由白色变成蓝色;③SO2中含有水蒸气;④C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色;⑤SO2中含有氢气。


科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )
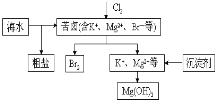
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)>2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢 (H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
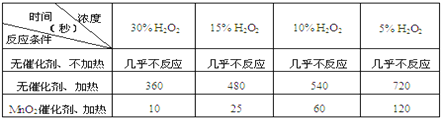
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解速率的影响
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响? 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:

①写出H2O2发生反应的化学反应方程式 。
②.实验结果说明催化剂作用的大小与 有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeBr2 + 3Cl2 = 2FeCl3+2Br2 ② Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是 (填反应序号),理由是 。
(二)请根据Fe + CuSO4 = FeSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极: ;负极: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对于晶体结构的持续探究揭开了晶体内部的奥秘,并合成了许许多多的新物质、新材料。回答下列问题:
(1)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 。
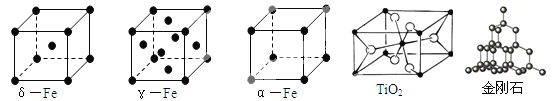
(2)TiO2的天然晶体中,最稳定的一种晶体结构如上图,白球表示: 原子。
(3)NaCl、CO2、SiO2三种晶体熔点由低到高的顺序是 。
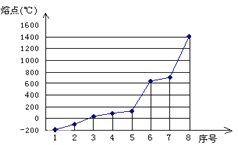
(4)第三周期八种元素按单质熔点由低到高的顺序排列如图所示,其中序号1和8分别代表的是 和 。
(5)已知:Cr3+可形成配位数为6的配合物。组成为CrCl3·6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3∶2∶1。则绿色配合物的化学式为 (选填代号)。
A.[CrCl(H2O)5]Cl2·H2O B.[CrCl2(H2O)4]Cl·2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]·3H2O
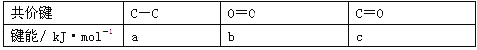
(6)根据下表所示键能,写出金刚石(结构如上图)完全燃烧时的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备
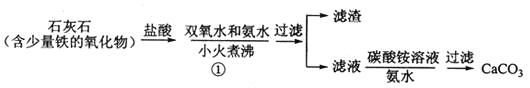
(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
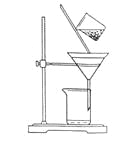
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证元素周期表中元素性质的递变规律,利用右图装置可验证同主族非金属性的变化规律。设计了如下系列实验。
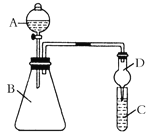
(1)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________________________。
(2)仪器A的名称为____________________,
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4, (KMnO4 与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液 的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3,C中加Na2SiO3 溶液观察到C中溶液_____________的现象,即可证明。但有的同学认为盐酸具有挥发性,应用__________溶液除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:
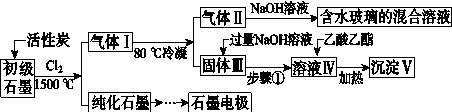
(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是 。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为 。由气体Ⅱ中某物得到水玻璃的化学反应方程式为 。
(3)步骤①为:搅拌、 。所得溶液Ⅳ中的阴离子有 。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为 ,
100kg初级石墨最多可能获得Ⅴ的质量为 kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
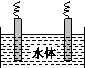
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com