
分析 (1)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,也可判断平衡状态;
(2)反应开始前,c(A)=$\frac{0.05mol}{0.5L}$=0.1mol/L,平衡时c(C)=0.04mol/L,据反应方程式计算;
(3)根据平衡时c(C)=0.04mol/L时放热Q1kJ,计算焓变;
(4)反应开始时,c(A)=0.1mol/L,c(B)=$\frac{0.025mol}{0.5L}$=0.05mol/L,平衡时c(C)=0.04mol/L,计算平衡常数;
(5)升温反应速率加快,但温度太高,酶的活性减弱,催化作用减弱,据此分析.
解答 解:(1)a、v(C)=2v(B),不能判断正反应速率和逆反应速率的关系,所以不能说明已经达到平衡状态,故错误;
b、单位时间内生成2mol A的同时消耗1molB,说明v逆(A)=2v逆(B)=2v正(B),故正确;
c、反应后气体的物质的量减小,所以容器内的压强减小,所以容器内压强保持不变,即是平衡状态,故正确;
d、反应后气体的体积不变,气体的质量也不变,所以容器内气体的密度始终保持不变,不能判断平衡状态,故错误;
e、单位时间内生成1molB的同时生成2mol A都是逆反应速率,不能说明反应达到平衡状态,故错误;
f、气体的平均分子量=$\frac{混合气体的质量总和}{混合气体的物质的量总和}$,反应前后气体质量不变,物质的量不同,所以气体的平均分子量不变,说明混合气体的物质的量不变,反应达到平衡状态,故正确;
g、混合气体的质量始终不变,所以混合气体的质量不变不能说明反应达到平衡状态,故错误;
h、A与B的浓度大小,决定于开始加入反应物的多少,与平衡状态无关,故错误;
故答案为:bcf;
(2)反应开始前,c(A)=$\frac{0.05mol}{0.5L}$=0.1mol/L,平衡时c(C)=0.04mol/L,则反应的c(A)=0.04mol/L,所以A的转化率为$\frac{0.04mol/L}{0.1mol/L}$×100%=40%,
故答案为:40%;
(3)根据平衡时c(C)=0.04mol/L时放热Q1kJ,可知2molA完全反应生成2molC放热100Q 1kJ,反应的热化学方程式为:2A(g)+B(g)═2C(g)△H=-100Q 1kJ•mol-1,故答案为:2A(g)+B(g)═2C(g)△H=-100Q 1kJ•mol-1;
(4)反应开始时,c(A)=0.1mol/L,c(B)=$\frac{0.025mol}{0.5L}$=0.05mol/L,平衡时c(C)=0.04mol/L,则平衡时,c(A)=0.06mol/L,c(B)=0.025mol/L,化学平衡常数K=$\frac{[C]^{2}}{[A]^{2}•[B]}$=$\frac{0.0{4}^{2}}{0.0{6}^{2}×0.025}$=$\frac{400}{27}$,故答案为:$\frac{400}{27}$;
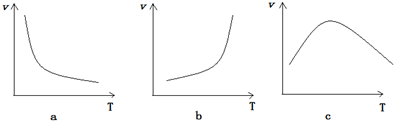
(5)升温反应速率加快,但温度太高,酶的活性减弱,催化作用减弱,图c符合题意,故答案为:c.
点评 本题考查了化学平衡状态的判断、转化率的计算、热化学方程式书写、化学平衡常数的计算、酶的催化作用,都是高考高频考点,注意掌握.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨水能与氯化镁反应生成MgCl2溶液反应 | |
| B. | 氨气易溶于水 | |
| C. | 0.1摩尔/升的NH4Cl的pH值约为5 | |
| D. | 氨水可以使得酚酞试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K3C60中既有离子键又有非极性键 | |
| B. | 1mol K3C60中含有的离子数目为3NA | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式不能写作KC20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L | B. | 2mol/L | C. | 2.5mol/L | D. | 3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
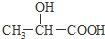 )和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )
)和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )| A. | 2 mol | B. | 2.25 mol | C. | 3 mol | D. | 3.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 第VIIA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 元素的最高正价数均等于该元素原子的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时化学能转化为电能 | |
| B. | 放电时,负极电极反应式为:CH3OH+8OH--6e-=CO${\;}_{3}^{2-}$+6H2O | |
| C. | 标况下,通入的11.2L氧气完全反应有1mol电子转移 | |
| D. | 充电时电解质溶液的碱性逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com