
| A. | 6 | B. | 8 | C. | 9 | D. | 11 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
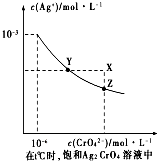 盐在化学工业中有重要的应用,请回答下列问题
盐在化学工业中有重要的应用,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的水溶液可以导电,说明NH3是电解质 | |
| B. | 海带中的碘为碘化钾,加硝酸银溶液有黄色沉淀产生 | |
| C. | 用酒精可萃取碘水中的碘单质 | |
| D. | 向淀粉碘化钾溶液中加入溴水,溶液变为蓝色,说明Br2的氧化性强于I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成单质分子的微粒中不一定含有化学键 | |
| B. | 只含有共价键的物质一定是共价化合物 | |
| C. | NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键 | |
| D. | CaCl2中既有共价键又有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
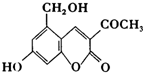 “亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题:
“亮菌甲素”的结构简式为如图所示,它配以辅料丙二1,3,5醇溶成针剂用于临床,而假药“亮菌甲素”是用廉价的二甘醇作为辅料.二甘醇为工业溶剂,有很强的毒性,会使肾功能衰竭.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 原子核内无中子 |
| Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Z | 地壳中含量最高的元素 |
| W | 原子质量数为23,中子数为12 |
| R | 其离子是第三周期金属元素的离子中半径最小的 |
 ,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com