
| A. | 稳定性:HF>HCl>HBr>HI | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 酸性:H2SO4>H3PO4>HClO4 | D. | 氧化性:O2>S>Se |
分析 A.非金属性越强,对应氢化物的稳定性越强;
B.金属性越强,最高价氧化物对应水合物的碱性越强;
C.非金属性越强,最高价氧化物对应水合物的酸性越强;
D.一般情况下,同一主族中元素原子序数越大,非金属性越弱,单质氧化性越弱.
解答 解:A.卤素的原子序数越大,非金属性越弱,对应氢化物的稳定性越弱,则氢化物稳定性大小为:HF>HCl>HBr>HI,故A正确;
B.碱金属元素的原子序数越大,金属性越弱,最高价氧化物对应水合物的碱性越弱,则碱性:NaOH>Mg(OH)2>Al(OH)3,故B正确;
C.非金属性:P<S<Cl,最高价氧化物对应水合物的酸性:HClO4>H2SO4>H3PO4,故C错误;
D.氧族元素中,随着原子序数递增,元素氧化性逐渐减弱,则氧化性:O2>S>Se,故D正确;
故选C.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,明确原子结构与元素周期律的关系为解答关键,注意掌握元素周期律内容、元素周期表结构,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
 ;MgF2
;MgF2 .
.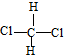 和
和

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将镁、铝的混合物7.5g溶于100mL 4mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液.请回答:
将镁、铝的混合物7.5g溶于100mL 4mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的正戊烷完全燃烧需要氧气分子数为4NA | |
| B. | 标准状况下,22.4L乙烷中所含电子对数目为6NA | |
| C. | 26g乙炔和苯的混合物,含有原子总数为4NA | |
| D. | 标准状况下,22.4L甲烷与氯气光照取代发生一氯取代,需要氯气0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、H+和H2是氢元素的五种不同粒子 | |
| B. | 石墨和金刚石互为同位素,化学性质相似 | |
| C. | ${\;}_{1}^{1}$H和 ${\;}_{1}^{2}$H是不同的核素 | |
| D. | 12C和 14C互为同位素,物理性质不同,但化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨在密林中看到一缕缕光束 | |
| B. | 盐酸与硝酸银溶液反应生成白色沉淀 | |
| C. | 豆浆中加入盐卤做豆腐 | |
| D. | 一束平行光射入蛋白质溶液中,侧面可看到一束光亮的通路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com