
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

请回答下列问题
(1)写出下列物质的化学式A___,E___。
(2)F在空气中转化为G的化学方程式:__。
(3)A和B反应的化学方程式:___。
(4)H和I生成J的离子方程式:___。
(5)如何检验E中大量存在的阳离子?__
【答案】Fe2O3 FeCl2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+Fe2O3![]() 2Fe+Al2O3 Al3++3AlO2-+6H2O=4Al(OH)3↓ 加入KSCN溶液无现象,再加入新制氯水溶液显血红色则证明有Fe2+
2Fe+Al2O3 Al3++3AlO2-+6H2O=4Al(OH)3↓ 加入KSCN溶液无现象,再加入新制氯水溶液显血红色则证明有Fe2+
【解析】
A是一种红棕色金属氧化物,则A是Fe2O3,红褐色沉淀G为Fe(OH)3,氢氧化铁分解可以生成氧化铁,则白色沉淀F是 Fe(OH)2;B、D是金属单质,Fe2O3和B在高温下能反应生成金属单质D,则该反应是铝热反应,B是Al,D是Fe,C是Al2O3,J是一种不溶于水的白色化合物,受热容易分解成C,则J是Al(OH)3,由转化关系可知,I是NaAlO2,H是AlCl3;铁和盐酸反应生成氯化亚铁和氢气,E和氨水反应生成 Fe(OH)2,则E是 FeCl2,以此解答该题。
(1)由以上分析可知,A为Fe2O3,E是FeCl2,故答案为:Fe2O3;FeCl2;
(2)氢氧化亚铁容易被空气中的氧气氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)A是Fe2O3,B为Al,高温下发生铝热反应生成氧化铝和铁: 2Al+Fe2O3![]() 2Fe+Al2O3,故答案为: 2Al+Fe2O3
2Fe+Al2O3,故答案为: 2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
(4)Al3+、AlO2发生双水解反应生成氢氧化铝,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(5)E是FeCl2,与KSCN不反应,但可被氧化生成铁离子,检验Fe2+的方法是:先加入KSCN无现象,再加入新制氯水溶液显血红色则有Fe2+,故答案为:加入KSCN溶液无现象,再加入新制氯水溶液显血红色则证明有Fe2+。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】含钒石煤(含有铁、硅、铝、钙、镁等元素的氧化物)中的钒大部分是以V(III)和V(IV)形式存在,由含矾石煤提钒的一种工艺流程如图所示:

已知:铜铁试剂能与铜、铁、铝、钛等元素形成不溶于水的配合物。
回答下列问题:
(1)含矾石煤预制时加入复合添加剂对钒浸出率的影响如图所示,其中最佳复合添加剂为__,最佳添加比例为__。

(2)如图为“抽滤”实验原理装置图,"抽滤”时抽气泵的作用是__;“酸浸渣”经“水洗涤”返回“浸出”的目的是__。

(3)已知酸浸液中V2O24+被H2O2氧化成VO2+,其离子方程式为__。“净化除杂”时用铜铁试剂除去所含的Al3+、Fe3+等杂质离子而不通过调节酸浸液pH的原因是__。
(4)“沉钒”的离子反应方程式为___。
(5)“煅烧”纯净的沉钒产物过程中,固体残留率与温度变化如图所示。已知A点坐标为(260℃,85.47%)。则A点对应物质的化学式为__,B点对应的物质为V2O5,则B点坐标为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为K=________。
(2)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是________,该反应的△H________0。(填“![]() ”、“
”、“![]() ”或“=”)
”或“=”)
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的关系为_______(用“![]() ”、“
”、“![]() ”或“=”连接)。
”或“=”连接)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)除去Na2CO3粉末中混入的NaHCO3杂质用__方法,化学方程式为__。
(2)除去氧化铜粉末中混入的氧化铝粉末通常用__试剂,离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝灰是铝加工行业的废渣,可能含有Al、![]() 、KCl、FeO、
、KCl、FeO、![]() 、MgO、
、MgO、![]() 、
、![]() 中的若干种。为了确认其成分,某同学依次进行了以下实验:
中的若干种。为了确认其成分,某同学依次进行了以下实验:
①将过量的稀盐酸加入铝灰中,充分反应后过滤得到溶液甲和固体乙;
②取少量溶液甲滴加![]() 溶液,生成白色沉淀;
溶液,生成白色沉淀;
③取少量溶液甲滴加KSCN溶液,溶液变成血红色;
④取少量溶液甲加入过量NaOH溶液,置于空气中充分反应后,经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁。
根据以上实验现象或数据,该同学得出的结论正确的是
A.根据①可推出铝灰中一定含有![]() B.根据②可推出铝灰中一定含有KCl
B.根据②可推出铝灰中一定含有KCl
C.根据③可推出铝灰中一定含有![]() D.根据④可推出固体丙中一定不含MgO
D.根据④可推出固体丙中一定不含MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物甲(![]() ,
,![]() ),性质类似卤素单质。将2.335g甲加热至完全分解,生成0.01mol液体乙和224mL(标准状况下)黄绿色的单质气体丙。请回答:
),性质类似卤素单质。将2.335g甲加热至完全分解,生成0.01mol液体乙和224mL(标准状况下)黄绿色的单质气体丙。请回答:
(1)甲加热至完全分解的化学方程式是________。
(2)乙与水反应的离子方程式是_________。
(3)下列有关化合物甲和乙的说法正确的是________。(填字母)
A.甲不能与可燃物、碱类一起储运
B.一定条件下乙能与乙烯或苯反应
C.甲分子中各原子均达到8电子稳定结构
D.粗碘中常混有乙,可直接用升华法分离提纯碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有大量的下列离子:Fe3+、NO3—、K+和M离子,经测定Fe3+、NO3—、K+和M离子的物质的量之比为2:5:1:1,则M离子可能是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有KNO3样品(含有少量杂质KCl、K2SO4),选择适当的试剂除去杂质,从而得到纯净的KNO3晶体,相应的实验流程如图所示。
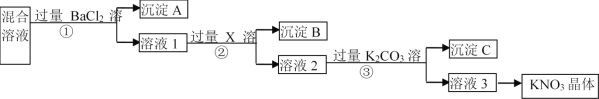
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X__,沉淀C__、__。
(2)上述实验流程中①②③步均要进行的实验操作是__(填操作名称)。
(3)生成沉淀A的离子方程式是__。
(4)此实验方案存在缺陷,还应__,之后若要获得纯净的KNO3晶体,需进行的实验操作是__、__(填操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com