
分析 (1)氢氧化钡溶液与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钡沉淀;
(2)CO32-+2H +=H2O+CO2 可以表示可溶性碳酸盐和强酸或者强酸的酸式盐反应生成可溶性盐和水、二氧化碳.
解答 解:(1)氢氧化钡溶液与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钡沉淀,离子方程式:Ba2++2OH-+Cu2++SO42-=Cu(OH)2↓+BaSO4↓;
故答案为:Ba2++2OH-+Cu2++SO42-=Cu(OH)2↓+BaSO4↓;
(2)CO32-+2H +=H2O+CO2 可以表示可溶性碳酸盐和强酸或者强酸的酸式盐反应生成可溶性盐和水、二氧化碳,可以表示碳酸钠与盐酸反应,化学方程式:Na2CO3+2 HCl=2NaCl+CO2↑+H2O;
故答案为:Na2CO3+2 HCl=2NaCl+CO2↑+H2O.
点评 本题考查了离子方程式的书写,明确物质的性质及反应实质是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明 CH3COOH 是弱电解质 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Kw均增大 | |
| C. | 25℃时,1.0×10-3mol•L-1盐酸的pH=3.0,1.0×10-8 mol•L-1盐酸的pH=8.0 | |
| D. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶液在电流作用下电离成K+和Cl- | |
| B. | 摩尔是表示物质所含微粒集体是多少的物理量 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 氧化还原反应的本质是有电子的转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 实验 | 现象 |
| A | 检验CO2气体中混有SO2 | 将气体通入盛有足量的澄清石灰水中的洗气瓶中 | 石灰水变浑浊 |
| B | 检验黑色固体Fe3O4中含有+3价铁元素 | 将少量黑色固体加入盛有KSCN溶液的烧杯中 | 固体溶解,溶液呈血红色 |
| C | 比较氯和碳的非金属性强弱 | 将碳酸钠溶液中滴入稀盐酸 | 有气泡产生 |
| D | 验证氧化性:Fe3+>Cu2+ | 将一定量铜粉加到盛有一定体积的1.0mol•L-1Fe2(SO4)3溶液的试管中 | 铜粉溶解,溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | NO2溶于水时发生氧化还原反应 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
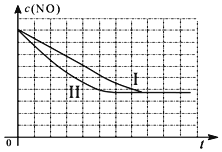
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有1mol Na2SO4 | B. | 1mol Na2SO4溶于1L水中 | ||
| C. | 溶液中c(Na+)=2 mol•L-1 | D. | 1L溶液中含有2molNa+,2mol SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com