
| A. | 该混盐具有和漂白粉相似的化学性质 | |
| B. | 该混盐的水溶液呈中性 | |
| C. | 该混盐与硫酸反应生成1摩尔氯气时,转移了1摩尔电子 | |
| D. | 该混盐中氯元素的化合价为零 |
分析 由混盐CaOCl2在酸性条件下可以产生Cl2.可知混盐为CaCl2•Ca(ClO)2的形式,在酸性条件下发生:Cl-+ClO-+2H+=Cl2↑+H2O,以此解答该题.
解答 解:A.混盐CaOCl2在酸性条件下可以产生Cl2,溶于水生成HClO,具有漂白性,与具有和漂白粉相似的化学性质,故A正确;
B.混盐为CaCl2•Ca(ClO)2的形式,溶液呈碱性,故B错误;
C.在酸性条件下发生:Cl-+ClO-+2H+=Cl2↑+H2O,由化合价可知产生1molCl2时转移1mole-,故C正确;
D.混盐为CaCl2•Ca(ClO)2的形式,氯元素的化合价分别为+1、-1价,故D错误.
故选AC.
点评 本题考查含氯化合物的性质,为高频考点,注意解答的关键是根据题意判断混盐的组成及发生的氧化还原反应,侧重分析与应用能力的考查,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol/L | B. | 0.5mol/L | C. | 0.045mol/L | D. | 0.45mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾一淀粉试纸检验,观察试纸颜色的变化 | |
| B. | 铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁 | |
| C. | 测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| D. | 向硅酸钠溶液中,滴入硫酸,可以验证S的非金属性强于Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤干馏和石油分馏本质差别是:干馏是化学变化而分馏是物理变化 | |
| D. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KH的水溶液呈碱性 | B. | KH中氢离子可以被还原为氢气 | ||
| C. | KH是一种强氧化剂 | D. | KH中的氢离子是裸露的质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
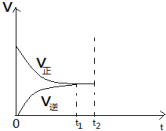 合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.
合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 8.8 | 17.6 | 22.0 |
| 气体体积/L | 2.24 | 4.48 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com