
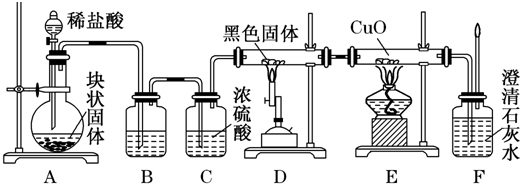
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、23g金属钠变为钠离子时得到的电子数为NA |
| B、标准状况下,18g水所含的电子数目为18NA |
| C、标准状况下,22.4 L氦气所含的原子数目为2NA |
| D、常温常压下,2.8g N2和CO的混合气体所含原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 预期现象与结论 |
| 现象: 结论: | |
查看答案和解析>>
科目:高中化学 来源: 题型:
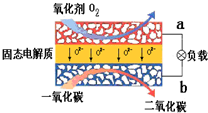 (1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是
(1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是查看答案和解析>>
科目:高中化学 来源: 题型:
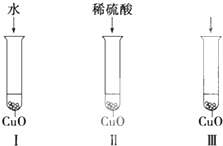 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
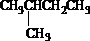
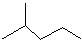
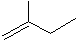
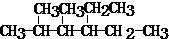
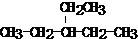
查看答案和解析>>
科目:高中化学 来源: 题型:
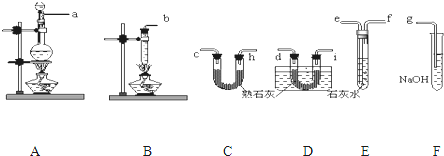
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com