
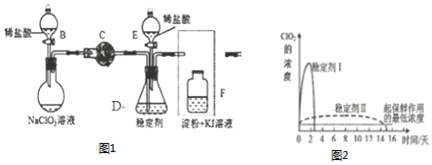
 .
.分析 (1)仪器B的名称是:分液漏斗;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气;
(2)根据电子转移守恒和原子守恒书写氯酸钠和稀盐酸混和产生Cl2和ClO2的反应化学方程式,为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,说明Cl2被吸收;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O;
(5)1.81g NaClO2的物质的量为:$\frac{1.81g}{90.5mol/L}$=0.02mol,由关系式:5ClO2-~~4ClO2↑,求二氧化氯的体积;在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
(6)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
解答 解:(1)仪器B的名称是:分液漏斗;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,所以方框中画出F中缺少的部分为: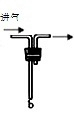 .
.
故答案为:分液漏斗; ;
;
(2)氯酸钠和稀盐酸混和产生Cl2和ClO2,NaClO3中氯为+5价被还原成ClO2中+4价,盐酸中氯为-1价,被氧化成0价氯,转移电子数为2,所以NaClO3、ClO2前系数为2,Cl2前系数为1,反应化学方程式:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,即调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度,
故答案为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;为使ClO2在D中被稳定剂充分吸收;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2,
故答案为:吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;
(5)1.81g NaClO2的物质的量为:$\frac{1.81g}{90.5mol/L}$=0.02mol,由关系式:5ClO2-~4ClO2↑,所以V=$\frac{0.02×4}{5}$×22.4=0.36L,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,故答案为:0.36L;检验是否有ClO2生成;
(6)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,故答案为:II;稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
点评 本题以ClO2的制备、吸收、释放为载体,考查实验制备方案设计、基本操作、对装置及操作的分析评价等,注意根据问题进行制备流程分析,题目难度中等.


科目:高中化学 来源: 题型:解答题

 (填写电子式).
(填写电子式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | |
| A | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| B | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| C | 制备氢氧化铁胶体 | 向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色 |
| D | 证明Mg(OH)2沉淀可转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
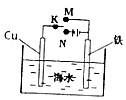
| A. | 电泳现象可证明胶体带电 | |
| B. | 如图装置,无论电键K接M还是接N,铁都能得到保护 | |
| C. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | 由反应2Fe2++Br2═2Fe3++2Br-可知,将1molCl2通入含1molFeBr2的溶液中能发生反应的离子方程为;2Cl2+2Fe2++2Br-═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
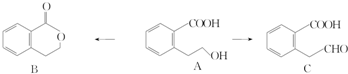
 (或
(或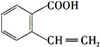 ),A分子中一定共面的碳原子有8个.
),A分子中一定共面的碳原子有8个.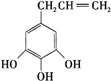 (或
(或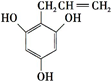 )(任写一种).
)(任写一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com