
| 离子 | 开始沉淀pH | 沉淀完全pH |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Zn2+ | 5.4 | 8.0 |
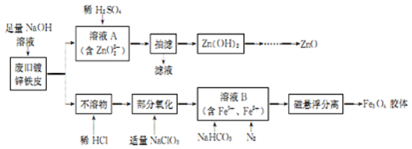
分析 粗氧化锌粉(含FeO、Fe2O3、ZnS等)加入稀硫酸溶解同时加入过氧化氢氧化,得到的溶液为硫酸锌、硫酸铁,过滤,调节溶液pH3.7~5.4,铁离子转化为Fe( OH)3沉淀,过滤分离,滤液中主要含有硫酸锌,向滤液中加NH4HCO3,得碱式碳酸锌沉淀,过滤、洗涤、煅烧,得产品,据此分析解答.
解答 解:(1)加入H2O2时能浸出硫化锌,同时生成淡黄色固体,由S生成,则化学方程式为:ZnS+H2O2+H2SO4=ZnSO4+2H2O+S;
故答案为:ZnS+H2O2+H2SO4=ZnSO4+2H2O+S;
(2)步骤2中调节溶液pH的目的是沉淀铁离子,不沉淀锌离子,由表可知,pH范围为:3.7~5.4;
故答案为:3.7~5.4;
(3)取洗涤、干燥后的碱式碳酸锌68.2g,充分灼烧后测得残留物质的质量为48.6g,则m(ZnO)=48.6g,n(ZnO)=$\frac{48.6g}{81g/mol}$=0.6mol,锌的质量为39g,
将所得气体通入足量澄清石灰水中,得沉淀20g,则m(碳酸钙)=20g,故n(碳酸根)=n(碳酸钙)=$\frac{20g}{100g/mol}$=0.2mol,
设氢氧根的物质的量为X,根据电荷守恒:0.6mol×2=0.2mol×2+X,
得氢氧根的物质的量为X=0.8mol,
碱式碳酸锌68.2 g减去锌的质量,碳酸根和氢氧根的质量,剩下的就为水的质量:68.2-39-0.2×60-0.8×17=3.6g,物质的量为0.2mol,
故碱式碳酸锌的组成ZnCO3•2Zn(OH)2•H2O 或Zn3(OH)4CO3•H2O;
答:碱式碳酸锌的组成为ZnCO3•2Zn(OH)2•H2O 或Zn3(OH)4CO3•H2O.
点评 本题考查物质的分离与提纯方法的综合应用及制备实验方案的设计,题目难度中等,涉及化学计算、氧化还原反应等知识,明确实验目的、实验原理为解答关键,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质一定是纯净物 | |
| B. | 科学家最近合成了一种新型的化合物N4 | |
| C. | 红磷转化为白磷是物理变化 | |
| D. | 纳米泡沫碳与金刚石是同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H4=$\frac{3}{2}$(△H1+△H2+3△H3) | B. | △H4=$\frac{2}{3}$(3△H3-△H1-△H2) | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2-3△H3) | D. | △H4=$\frac{3}{2}$(△H1-△H2-3△H3) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
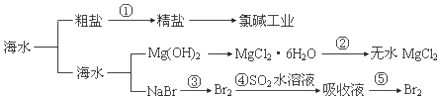
| A. | 粗盐可采用除杂和重结晶等过程提纯 | |
| B. | 工业生产中常选用石灰乳作为 Mg2+的沉淀剂 | |
| C. | 第②步的反应条件是:在空气中直接加热 | |
| D. | 第③步到第⑤步的目的是为了富集溴元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com