
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是

A. 混合酸中NO3-物质的量为0.4mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为5 mol·L-1
【答案】D
【解析】试题分析:A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以n(NO3-)=2n(Fe)=2×(11.2g÷56g/mol)=0.4mol,正确;B.由图像可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,正确;C.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,正确;D.反应消耗22.4g铁,也就是22.4g÷56g/mol=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所以硫酸的浓度是c=0.4mol÷0.1L=4mol/l,错误。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计了如下装置进行试验探究,请回答下列问题:
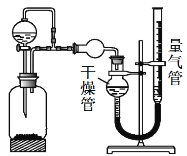
(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处水平,还应注意 。考虑到分液漏斗滴入瓶中液体的体积(其它操作都正确),则该装置测得气体的体积将 (填“偏大”、“偏小”或“无影响”)。
(2)若在瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀。
①通过分液漏斗向瓶中加入的试剂可选用下列 (填序号)
a.NaOH溶液 B.C2H5OH c.NaCl溶液 D.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是 。
(3)若瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度。你认为此方法是否可行 (填“可行”或“不可行”),若填“不可行”请说明原因 。
(4)为探究MnO2在H2O2制取O2过程中的作用,分别将等量 H2O2加入到瓶中,进行2次实验(气体体积在同一状况下测定):
序号 | 瓶中的物质 | 分液漏斗的物质 | 测得气体体积 |
实验1 | 足量MnO2 | 20mL H2O2 | V1 |
实验2 | 稀硫酸和足量MnO2 | 20mL H2O2 | V1<V2<2V1 |
若实验1中MnO2的作用是催化剂,则实验2中发生反应的化学方程式为 。
(5)若瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
Ⅰ | 1.0 g | 10.00 mL | 346.30 mL |
Ⅱ | 1.0 g | 10.00 mL | 335.50 mL |
Ⅲ | 1.0g | 10.00 mL | 346.00 mL |
Ⅳ | 1.0 g | 10.00 mL | 345.70 mL |
则镁铝合金中镁的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于取代反应的是( )
①乙酸与乙醇反应生成乙酸乙酯;②乙烯通入溴水中;③在镍作催化剂的条件下,苯与氢气反应;④苯与液溴混合后撒入铁粉
A. ①② B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再进行测定。
(1)在高温下将x克钢样中碳、硫转化为CO2、SO2(气体a)。
(2)将气体a通入测硫装置中(如图1),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:___________ ______。
②将①的吸收液稀释至250mL,取1/10该溶液进行滴定,用酸式滴定管取液时赶走气泡的操作是_ 。
③用c mol/L 标准 NaOH 溶液滴定取出的溶液,则选择的指示剂为_________,直至加入最后一滴NaOH溶液时,溶液颜色_________,即可停止滴定。
④某次滴定前后,NaOH 溶液的液面如图2,其体积读数为________________________。若滴定3次,消耗NaOH溶液体积的平均值为z mL,则该钢样中硫的质量分数为______________________(用 x、c、z表示)。
⑤下列操作会造成测定结果偏高的是__________。
a.水洗后未用标准液润洗碱式滴定管 b.加入1 mL酸碱指示剂
c.滴定终点时,尖嘴出现气泡 d.滴定终点俯视滴定管的刻度

将气体 a 通入测碳装置中(如图),采用重量法测定碳的含量。
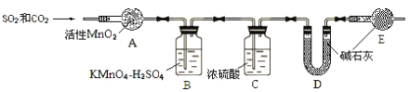
⑥为准确测定CO2,需除去SO2的干扰,除去SO2的装置是_______(填序号)。
⑦计算钢样中碳的质量分数,应测量的数据是__________。去掉装置E,测得碳的质量分数 (填 “偏小”、“无影响”或“偏大”)
⑧上述操作中,测定CO2前先除去SO2,但测定SO2前却没除CO2,是否合理?若不合理,说明如何改正;若合理,说明理由_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿佛加德罗常数,下列说法正确的是:
A. 14 g 氮气中含有7NA个电子
B. 1 mol Cl2作为氧化剂得到的电子数为NA
C. 标准状况下,2. 24 L的CCl4中含有的C—Cl键数为0. 4NA
D. 常温常压下,3. 0 g含甲醛的冰醋酸中含有的原子总数为0. 4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com