
分析 (1)1molCO的质量为28g,1molCO含有NA个分子,据此计算CO分子质量;
(2)平均摩尔质量$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$.
解答 解:(1)每摩尔一氧化碳的质量为28克,每摩尔氧化碳含有NA个分子,所以每个分子的质量为$\frac{28}{N_A}$g,故答案为:$\frac{28}{N_A}$;
(2)混合气体的物质的量为n=$\frac{11.2L}{22.4L/mol}$=0.5mol,所以平均摩尔质量为$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$=$\frac{18g}{0.5mol}$=36g/mol,故答案为:36g/mol.
点评 本题考查了混合物的平均摩尔质量的求算、一个分子质量的求算等,解题关键是公式的灵活运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①④都要用到锥形瓶 | B. | ②③都要用到温度计 | ||
| C. | ③④都要用到酒精灯 | D. | ①②都要用到指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=8.3 的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
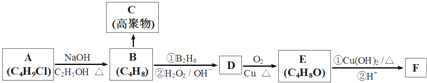
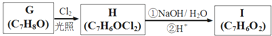
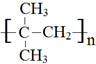 ,
,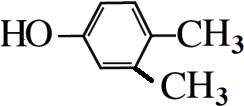 .
.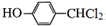 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaCl+2H2O.
+2NaCl+2H2O.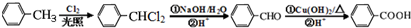 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com