
【题目】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如表(KMnO4溶液用稀硫酸酸化),实验装置如图1:

实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.0lmol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.01mol·L-1KMnO4溶液 |
(1)该反应的化学方程式为__________。
(2)该实验探究的是__________因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积
大小关系是__________ < __________ (填实验序号)。
(3)若实验①在2min末收集了 2.24mLCO2 (标准状况下),则在2min末,c(MnO4-) =__________ mol·L-1。(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定__________来比较化学反应速率。(一条即可)
(5)小组同学发现反应速率随时间的变化如图2所示,其中t1t2时间内速率变快的主要原因可能是:
①__________ ; ②__________ 。
【答案】 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O 浓度 ① ② 0.0056 KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间 该反应放热 产物Mn2+是反应的催化剂
【解析】(1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,KMnO4和中锰降低了5价,1个H2C2O4分子中有2个+3价的C,所以升高1×2=2价,根据化合价升降总数相等可以确定KMnO4和H2C2O4的比例关系为:2:5,再根据电荷守恒配平离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)对比①②实验可探究草酸的浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,相同时间所得CO2的体积大;
(3)CO2的物质的量为: ![]() =0.0001mol,设2min末,反应消耗的n(MnO4-)为x,
=0.0001mol,设2min末,反应消耗的n(MnO4-)为x,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
210
x0.0001mol
解得 x=0.00002mol
反应剩余的高锰酸根离子的物质的量为:30×10-3L×0.01molL-1-0.00002mol=0.00028mol
c(MnO4-)=![]() =
=![]() =0.0056mol/L;
=0.0056mol/L;
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;
(5)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率;②产物Mn2+是反应的催化剂。


科目:高中化学 来源: 题型:
【题目】我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质﹣青蒿素而荣获2015年诺贝尔奖.科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚.下列说法不正确的是
A. 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B. 双氢青蒿素在水中的溶解性大于青蒿素
C. ①、②的反应类型分别为还原反应、取代反应
D. 青蒿素转化为双氢青蒿素,手性碳个数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,一种新的制备联氨(N2H4)的方法分为两步。
第一步: NH3和Cl2在液态丙酮![]() 中反应合成异肼
中反应合成异肼![]() ,同时有“白烟”产生;
,同时有“白烟”产生;
第二步:异胼水解生成联氨和丙酮。
巳知:通常条件下,联氨是易吸收水和CO2的液体:碱性条件下,能与AgNO3溶液反应生成Ag和N2。
请回答下列问题:
某小组在实验室应用上述方法制备联氨水合物并测定该水合物的组成,设计实验如下(夹持装置略去)。
I.联氨水合物的制备。

(1)上述装置正确的连接顺序为a―(________)―bc― ( )― ( ) f(填仪器接口字母),盛放丙酮的仪器名称为____________。
(2)用连接好的装置进行实验;
①检验装置的气密性,加入药品;
②排尽装置中的空气;
③向丙酮中缓慢通入NH3和Cl2,进行第一步反应,该反应的化学方程式为____________。 设计实验证明“白烟”的主要成分为NH4Cl:____________;
④完全反应后,再向其中滴加足量蒸馏水,发生第二歩反应。
Ⅱ.测定联氨水水合物的组成。
(3)实验步骤:
①取装置B中完全反应后的液体,蒸馏,收集联氨水合物。下列蒸馏装置中合理的是________(填选项字母,夹持装置略去),若蒸馏操作开始后,发现蒸馏烧瓶中没有添加沸石,处理方法为_______________。

②取5.0 g联氨水合物,加人适量NaOH溶液,再加人足量AgNO3溶液;充分反应后,过滤、洗涤、干燥、称量,得固体质量为43.2g,则联氨水合物的化学式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础,研究物质的组成、结构、性质及其变化规律的自然科学。学习科学研究的基本方法,可以加深对科学本质的认识,增进对物质世界的认识。下列有关叙述不正确的是

A. 用测定接近水的沸点的水蒸气相对分子质量的方法可知水分子间可以形成氢键
B. 相对分子质量的测定常用质谱仪,在质谱仪内,有机化合物分子在高真空环境下被高能电子束轰击后主要形成带负电的碎片
C. 利用红外光谱、核磁共振氢谱等现代物理方法或化学方法均可测定C2H6O的分子结构
D. 某有机物分子式为C11H14O2,其H—NMR图谱如右图(峰右侧或上面的数字表示H的个数,且知:7.2ppm(5H)为苯基),可推测该有机物可能为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:

(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂。该实验__________(填“能”或“不能”)达到目的,原因是__________。(若能,不必回答原因)
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
试管 | 夏 | II | III |
滴加试剂 | 5滴0.lmol·L-1FeCl3 | 5 滴 0.1mol·L-1 CuCl2 | 5 滴 0.3mol·L-1 NaCl |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
由此得到的结论是__________,设计实验Ⅲ的目的是__________。
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,査阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和__________(按反应发生的顺序写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于一定体积密闭容器中的反应:N2(g)+3H2(g)![]() NH3(g)(正反应为放热反应),673K、30MP下,n (NH3)和n (H2)随时间t变化的关系如图所示.下列叙述中,不正确的是()
NH3(g)(正反应为放热反应),673K、30MP下,n (NH3)和n (H2)随时间t变化的关系如图所示.下列叙述中,不正确的是()

A. 点c处正反应速率比逆反应速率大 B. 点a的正反应速率比点b的正反应速率大
C. 气体的平均摩尔质量:点b大于点a D. 混合气体的密度:点b大于点a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表述一定正确的是
A.甲醛的电子式:![]()
B.苯酚钠溶液中中通入少量二氧化碳气体:![]()
C.溴乙烷与氢氧化钠水溶液共热:![]()
D.乙醇与灼热的氧化铜反应:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列给出的各组物质,不能完成下列转化的是( )
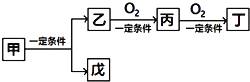
物质 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | C6H12O6 | CH3CH2OH | CH3CHO | CH3COOH | CO2 |
B | NH4Cl | NH3 | N2 | NO2 | HCl |
C | NaCl | Na | Na2O | Na2O2 | Cl2 |
D | CH4 | C | CO | CO2 | H2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com