

分析 以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙,由制备流程可知,碳酸钙与盐酸反应,溶解后加氢氧化钙除去Al3+、Fe3+等杂质,过滤分离出沉淀,滤液加盐酸除去过量的碱,蒸发结晶可得到CaCl2•2H2O,但温度过高时CaCl2•2H2O分解失去结晶水,并结合CaCl2•2H2O~2Cl-~2AgNO3计算.
解答 解:(1)CaCO3与盐酸反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;
(2)过滤分离出Fe(OH)3、Al(OH)3,需要烧杯、漏斗、玻璃棒,故答案为:普通漏斗;Fe(OH)3、Al(OH)3;
(3)酸化时加盐酸的目的为:①除去过量的氢氧化钙,②防止Ca2+在蒸发时发生水解,故答案为:除去过量的氢氧化钙;
(4)蒸发结晶要保持在160℃,是因温度太高CaCl2•2H2O会失水,故答案为:温度太高CaCl2•2H2O会失水;
(5)①称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL,由CaCl2•2H2O~2Cl-~2AgNO3可知,样品中含CaCl2•2H2O的质量分数为$\frac{0.04mol/L×0.02039L×\frac{1}{2}×\frac{250}{25}×147g/mol}{0.7522g}$×100%,
故答案为:$\frac{0.04mol/L×0.02039L×\frac{1}{2}×\frac{250}{25}×147g/mol}{0.7522g}$×100%;
②若所测样品 CaCl2•2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为Na+没除去析出NaCl,消耗的硝酸银偏大,导致测定结果偏大,故答案为:Na+没除去析出NaCl,导致测定结果偏大.
点评 本题考查物质的制备实验,为高频考点,把握流程中发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意含量计算结合关系式,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有大量Ba2+的溶液:Cl- K+ SO42- CO32- | |
| B. | 含有大量H+的溶液:Mg2+ Na+ SO42- CO32- | |
| C. | 含有大量 OH-的溶液:Cu2+ NO3- SO42- CO32- | |
| D. | 含有大量Na+的溶液:H+ K+ SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34S2-的结构示意图: | B. | H2O2的电子式: | ||
| C. | 甲烷分子的比例模型: | D. | 中子数为18的硫原子:${\;}_{16}^{18}$S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4溶液中滴加NaOH浓液 | B. | 碳酸氢钠溶液中滴加稀盐酸溶液 | ||
| C. | 硫酸铁溶液中滴加硫氰化钾溶液 | D. | 氯化铁溶液中加入还原性铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①③④ | C. | ①③⑤⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
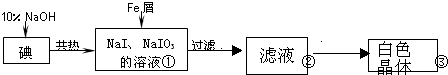
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 | / |
| 取少量溶液液于试管A中,加入足量的1mol/LH2SO4. | 溶液显蓝色 | 溶液中含IO3- |
| 另取少量溶液液于试管B中,滴入几滴酚酞溶液. | 溶液变红. | 溶液中含大量0H- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜 | B. | 水银 | C. | 硬铝 | D. | 碳素钢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com