
| A. | 至少存在5种离子 | |
| B. | C1-一定存在,且c Cl-)≥0.4mol/L | |
| C. | SO42-、NH4+一定存在,CO32-可能存在 | |
| D. | CO32-、Al3+一定不存在,K+一定存在 |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在NH4+;
红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,n(Fe3+)=$\frac{1.6g}{160g/mol}$×2=0.02mol,一定没有CO32-;
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,含SO42-的物质的量为0.02mol,结合电荷守恒及离子共存来解答.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在NH4+;
红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,n(Fe3+)=$\frac{1.6g}{160g/mol}$×2=0.02mol,一定没有CO32-;
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,含SO42-的物质的量为0.02mol,
溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,
由电荷守恒,知溶液中必然大量存在另一种阴离子Cl-,故原溶液中一定含Fe3+、NH4+、SO42-和Cl-,不能确定是否含Al3+和K+,
A.由上述分析可知,至少存在4种离子,故A错误;
B.由电荷守恒可知,C1-一定存在,且c Cl-)≥$\frac{0.08mol-0.04mol}{0.1L}$=0.4mol/L,故B正确;
C.SO42-、NH4+一定存在,CO32-一定不存在,故C错误;
D.CO32-一定不存在,K+、Al3+不能确定是否存在,故D错误;
故选B.
点评 本题考查常见离子的检验,为高频考点,把握发生的离子反应、电荷守恒为解答的关键,侧重分析与实验能力的考查,注意电荷守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
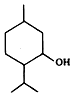
| A. | 薄荷醇属于芳香烃的含氧衍生物 | |
| B. | 薄荷醇分子式为C10H20O,它是环己醇的同系物 | |
| C. | 薄荷醇环上的一氯取代物只有三种 | |
| D. | 在一定条件下,薄荷醇能与氢气、溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:d>c>b>a | B. | 离子半径:W2+>X+>Y2->Z- | ||
| C. | 原子半径:Z<Y<W<X | D. | 最低负价:X<W<Z<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:P4(白磷,s)═4P(红磷,s),△H<0,则白磷比红磷稳定 | |
| B. | 由S (s)+O2(g)═SO2(g) (g)△H=-296.8 kJ•mol-1可知硫的标准燃烧热为296.8 kJ•mol-1 | |
| C. | OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ•mol-1,故1 mol醋酸与1 mol NaOH完全反应,放出的热量为57.3 kJ•mol-1 | |
| D. | 甲醇燃料电池中,通入甲醇的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | I | II | III |
| 盐酸体积(mL) | 50.0 | 50.0 | 50.0 |
| 样品质量/g | 9.2 | 15.7 | 27.6 |
| CO2体积/L (标准状况) | 2.24 | 3.36 | 3.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
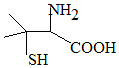 靑霉素是最重要的抗生素,其在体内经酸性水解后得到一种有机物X.己知X的结构如图,下列有关X的说法正确的是( )
靑霉素是最重要的抗生素,其在体内经酸性水解后得到一种有机物X.己知X的结构如图,下列有关X的说法正确的是( )| A. | X为烃的含氧衍生物 | |
| B. | X的分子式为C5H10NO2S | |
| C. | X只能发生取代反应 | |
| D. | X中碳原子上的H若有1个被Cl取代,有2种不同产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外有2个电子层 | B. | 最外电子层上有2个电子 | ||
| C. | 比4He多1个中子 | D. | 比4He少 1个质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com