
【题目】前四周期主族元素X、Y、M、N的信息如下:
有关信息 | |
X | X元素的原子最外层电子数是电子层数的3倍 |
Y | Y元素所在主族序数与周期序数之差为4,Y是同周期中原子半径最小的元素 |
M | 常温下单质呈液态的非金属元素 |
N | N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)M元素在周期表中的位置______________________。
(2)Y元素的简单阴离子结构示意图_______________。
(3)化合物N2X2的电子式为_______________,试写出它的一种用途_______________。
(4)设计方案证明M、Y元素的得电子能力强弱:______________________________________。
(5)Y的单质是一种重要的化工原料,在工农业生产、生活中有着重要的应用。为探究Y单质的性质,某同学设计了如图所示的实验装置。
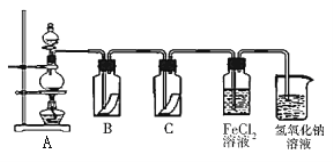
①实验中制取气体的化学方程式为:__________________________________________,该反应中氧化剂和还原剂的物质的量之比为_________________________
②装置B、C中依次放的是干燥的红色布条和湿润的红色布条,理论上装置_____中的红色布条褪色,但实验过程中该同学发现装置B、C中的布条均褪色,其原因可能是_________________。
③写出该气体与FeCl2溶液反应的离子方程式____________________________________。
④工业上常用石灰乳吸收制该气体制得漂白粉,漂白粉的必须密封保存,否则易失效,原因是____(用化学方程式表示)。
【答案】第四周期第VIIA族 
![]() 供氧剂或漂白剂 取NaBr溶液少许于试管中,滴加氯水,振荡,然后滴入CCl4,振荡静置,观察到液体分层,下层呈橙色 MnO2+4HCl(浓)
供氧剂或漂白剂 取NaBr溶液少许于试管中,滴加氯水,振荡,然后滴入CCl4,振荡静置,观察到液体分层,下层呈橙色 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 1:2 C Cl2中可能混有少量的水蒸气 2Fe2++Cl2=2Fe3++2Cl﹣ Ca(ClO)2+CO2+H2O=CaCO3+2HClO,2HClO
MnCl2+Cl2↑+2H2O 1:2 C Cl2中可能混有少量的水蒸气 2Fe2++Cl2=2Fe3++2Cl﹣ Ca(ClO)2+CO2+H2O=CaCO3+2HClO,2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
(1)X元素的原子最外层电子数是电子层数的3倍,则X核外电子排布是2、6,X是O元素;
(2) Y元素所在主族序数与所在周期序数之差为4,Y是同周期中原子半径最小的元素,则Y是Cl元素;
(3)常温下M单质是呈液态的非金属元素,则M是Br元素;
N的化合物在灼烧时焰色呈黄色,故N为Na元素,以此解答该题。
根据上述分析可知:X是O,Y是Cl,M是Br,N是Na元素。
(1)M是Br元素,原子核外电子排布是2、8、18、7,位于元素周期表第四周期第ⅦA族;
(2)Y为Cl,Cl元素的简单阴离子Cl-是Cl原子得到1个电子形成的阴离子,最外层满足8个电子的稳定结构,共有3个电子层,Cl-的结构示意图为: ;
;
(3)X是O,N是Na元素,则N2X2是Na2O2,该化合物是离子化合物,Na+与O22-通过离子键结合,O22-中2个O原子之间通过共价键结合,其电子式为:![]() ;该物质与H2O、CO2反应产生氧气,因此常用作呼吸面具的供氧剂;由于其具有强的氧化性,能够将有色物质氧化变为无色物质,也常作漂白剂;
;该物质与H2O、CO2反应产生氧气,因此常用作呼吸面具的供氧剂;由于其具有强的氧化性,能够将有色物质氧化变为无色物质,也常作漂白剂;
(4)元素的非金属性:Cl>Br,元素的非金属性越强,其单质的氧化性就越强,活动性强的可以将活动性弱的置换出来,因此可以把少量氯滴入到NaBr溶液中,振荡,然后加入CCl4,振荡,若液体分层,下层呈橙色,就证明发生反应:Cl2+2NaBr=2NaCl+Br2,说明Cl元素得到电子的能力比Br元素强;
(5)①在A中浓盐酸与MnO2混合加热,发生反应制取氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,在该反应中MnO2为氧化剂,HCl为还原剂,1 mol MnO2反应消耗4 mol HCl,其中2 mol HCl被氧化,做还原剂,失去电子变为Cl2,另外2 mol HCl其酸的作用,反应后与Mn2+结合为MnCl2,故该反应中氧化剂和还原剂的物质的量之比为1:2;
MnCl2+Cl2↑+2H2O,在该反应中MnO2为氧化剂,HCl为还原剂,1 mol MnO2反应消耗4 mol HCl,其中2 mol HCl被氧化,做还原剂,失去电子变为Cl2,另外2 mol HCl其酸的作用,反应后与Mn2+结合为MnCl2,故该反应中氧化剂和还原剂的物质的量之比为1:2;
②干燥的氯气不具有漂白性,潮湿的氯气中氯气与水反应产生的HClO具有漂白性,因此能够使有色物质褪色。在装置B、C中依次放的是干燥的红色布条和湿润的红色布条,理论上装置C中的红色布条褪色,但实验过程中该同学发现装置B、C中的布条均褪色,其原因可能是Cl2中可能混有少量的水蒸气,Cl2与H2O反应产生了具有漂白作用的HClO;
③Cl2具有强的氧化性,可以将Fe2+氧化产生Fe3+,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl﹣;
④漂白粉的有效成分是Ca(ClO)2,由于酸性:H2CO3>HClO,漂白粉会与空气中CO2及H2O发生反应:Ca(ClO)2+CO2+H2O=CaCO3+2HClO,反应产生的HClO不稳定,光照分解产生HCl、O2,反应方程式为:2HClO![]() 2HCl+O2↑,因此漂白粉必须密封保存在阴暗处,否则易失效。
2HCl+O2↑,因此漂白粉必须密封保存在阴暗处,否则易失效。


科目:高中化学 来源: 题型:
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3 nm深紫外激光倍频输出,其晶胞如图所示。下列说法错误的是( )
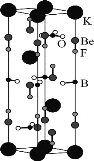
A. 构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B. KBF4中的阴离子的中心原子的杂化方式为sp2
C. 根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
D. 晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mo1该晶胞含3molKBe2BO3F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
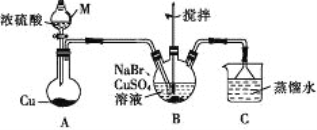
(1)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为____(填化学式)。
(2)B中发生反应的化学方程式为_____,能说明B中反应已完成的依据是_____。若B中Cu2+仍未完全被还原,适宜加入的试剂是____(填标号)。
A.液溴 B.Na2SO4 C.铁粉 D.Na2S2O3
(3)下列关于过滤的叙述不正确的是___(填标号)。
a.漏斗末端颈尖可以不紧靠烧杯壁 b.将滤纸润湿,使其紧贴漏斗内壁
c.滤纸边缘可以高出漏斗口 d.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(4)洗涤时,先用装置C中的吸收液清洗,其目的是______,再依次用溶解SO2的乙醇、乙醚洗涤的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
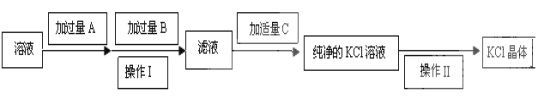
(1)写出上述试剂的化学式:A_____________________。
(2)上述操作Ⅰ所用玻璃仪器的名称是__________________;操作Ⅱ的名称是_____________。
(3)加过量A时发生有关反应的离子反应方程式为:_________________、__________________。
(4)检验试剂B是否过量的方法:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、_________,操作Ⅱ的名称是_______________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
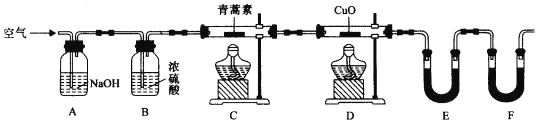
①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:

则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:

由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )

A.平衡状态Ⅱ时的c(H2)一定小B.平衡状态Ⅱ时的c(NH3)一定大
C.平衡常数K一样大D.平衡状态Ⅱ时的v(正)一定大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=__________kJ·mol-1。
(2)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
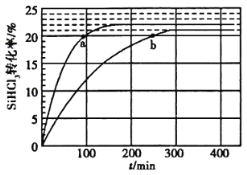
① 343K时反应的平衡转化率α=__________%。平衡常数表达式__________。
②在343K下,要提高SiHCl3转化率,可采取的措施是__________;要缩短反应达到平衡的时间,可采取的措施有__________、__________。
③比较a、b处反应速率大小:va__________vb(填“大于”“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com