


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
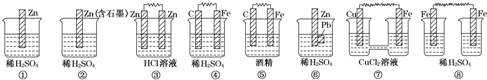
 反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A、A、C两点的反应速率:A>C |
| B、A、C两点气体的颜色:A深,C浅 |
| C、由状态B到状态A,可以用加热的方法 |
| D、A、C两点气体的转化率:A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
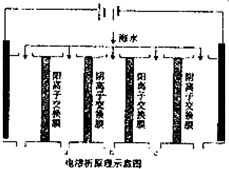 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等.
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等. ,请写出ABS的结构简式
,请写出ABS的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、NO3-、OH- |
| B、H+、K+、CO32- |
| C、Cu2+、S2-、Cl- |
| D、Fe3+、Na+、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com