
(12分)A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
元素 | A | B | C | D | E |
性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
试回答以下问题
(1)B在周期表中的位置是 ,B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式 。
(3)写出丙的电子式为 。并说明丙在空气中漂白的原理(用化学方程式表示) 。(请参考下表数据)
酸 | 电离常数 |
HClO | Ka=3.0×10-8 |
H2CO3 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式 。
(1)第二周期VA族;NH3;(2)Na3N+3H2O  3NaOH+NH3;
3NaOH+NH3;
(3)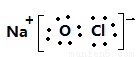 , NaClO + CO2 + H2O
, NaClO + CO2 + H2O HClO + Na HCO3;
HClO + Na HCO3;
(4)Cu +2 NO2- +4H+ = Cu2+ +2NO↑+2 H2O。
【解析】
试题分析:根据题给信息知,钠在空气中燃烧生成淡黄色固体过氧化钠,D为Na;D3B中阴阳离子电子层结构相同,B为N;则A为H、C为O、E为Cl。(1)N位于第二周期VA族。NH3存在分子间氢键,HCl分子间不存在氢键,NH3的沸点高于HCl;(2)Na3N与H2O生成NaOH与NH3,化学方程式为Na3N+3H2O  3NaOH+NH3;(3)丙为次氯酸钠,电子式为
3NaOH+NH3;(3)丙为次氯酸钠,电子式为 ,根据题给信息知,酸性:H2CO3>HClO>HCO3—,则丙在空气中漂白的原理为NaClO + CO2 + H2O
,根据题给信息知,酸性:H2CO3>HClO>HCO3—,则丙在空气中漂白的原理为NaClO + CO2 + H2O HClO + Na HCO3;(4)丁为NaNO2,酸性条件下,NO2-具有氧化性,能将Cu氧化生成Cu2+,NO2-本身被还原为NO,化学方程式为Cu +2 NO2- +4H+ = Cu2+ +2NO↑+2 H2O。
HClO + Na HCO3;(4)丁为NaNO2,酸性条件下,NO2-具有氧化性,能将Cu氧化生成Cu2+,NO2-本身被还原为NO,化学方程式为Cu +2 NO2- +4H+ = Cu2+ +2NO↑+2 H2O。
考点:考查元素推断及相关物质的结构和性质。


科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
Al、Fe、Cu都是重要的金属元素,下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制 备AlCl3、FeCl3、CuCl2固体均不能采用将溶液
备AlCl3、FeCl3、CuCl2固体均不能采用将溶液 直接蒸干的方法
直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2 的混合溶液时阴极上依次析出Cu、Fe、Al
的混合溶液时阴极上依次析出Cu、Fe、Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:填空题
(14分)汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
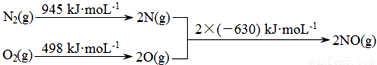
则该反应的热化学方程式为 。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx == 2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下的N2体积 L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇: CO(g)+2H2(g)  CH3OH(g);△H= -b kJ?mol-1
CH3OH(g);△H= -b kJ?mol-1
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
③经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO) =0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1, 则此时v正 v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________。电池工作时,固体电解质里的O2-向_______极移动。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:选择题
阿维A酯是一种皮肤病用药,可由原料X经过多步反应合成:
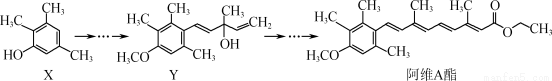
下列叙述正确的是
A.有机物X与Y互为同系物
B.有机物Y与阿维A酯均能与NaOH溶液反应
C.一定条件下1 mol阿维A酯能与4 mol H2发生加成反应
D.X中有6种化学环境不同的氢原子,Y中有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.已知 则可以计算CH3—CH3 → CH2=CH2+H2;ΔH =+125.6 kJ/mol
则可以计算CH3—CH3 → CH2=CH2+H2;ΔH =+125.6 kJ/mol
B.能说明NH3结合H+能力比H2O强:NH3+H3O+=NH+4+H2O
C.已知下列热化学方程式:2H2(g)+O2(g) === 2H2O(g) △H=-484kJ/mol,则氢气的燃烧热为-242kJ/mol
D.已知中和热为-57.4kJ/mol ,则NaOH(aq) +CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H =-57.4kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是
A.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水
B.Na2FeO4既是氧化产物又是还原产物
C.Na2O2在上述反应中只作氧化剂
D.2 mol FeSO4发生反应时,共有10 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
A.当x=0.2,则混合溶液中y可能大于7或小于7
B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-)
C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
下表中对应关系错误的是
A | NaCl=Na++Cl-;NH3?H2O | 均属于电离方程式 |
B | Ba2++SO42-=BaSO4↓; HCO3-+OH-=CO32-+H2O | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色; SO2使碱性酚酞溶液褪色 | 均属于SO2的同一性质 |
D | Cl2+2NaOH=NaCl+NaClO+H2O; 3S+ 6NaOH=2Na2S+Na2SO3+3H2O; | Cl2和S在反应中既作氧化剂又作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com