
【题目】肯定属于同族元素且性质相似的是( )
A.原子核外电子排布式:A为1s22s2 , B为1s2
B.结构示意图:A为 ![]() ,B为
,B为 ![]()
C.A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D.A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A. Ca2+ Na+ NO3﹣ Cl﹣ B. Na+ K+ CO32﹣ H+
C. Ba2+ Cu2+ SO42﹣ OH﹣ D. Ca2+ K+ CO32﹣ Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是( ) 
A.试管a中实验可以证明SO2具有漂白性
B.试管b中溶液褪色,说明SO2具有强氧化性
C.试管c中能产生白色沉淀,说明SO2具有还原性
D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸的性质,设计了如下图所示的装置进行实验。
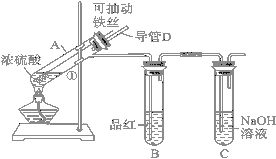
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是________________。
(2)说明SO2气体产生的实验现象是___________;装置C的作用是______________。
(3)反应一段时间后,他们对试管A中溶液的金属离子进行探究,请完成相关试题:
① 提出假设: 假设1:只含有Fe3+;
假设2:只含有Fe2+;
假设3:既有Fe2+,又有Fe3+。
② 请设计实验方案验证假设3。
限选试剂:稀硫酸、KMnO4溶液、KSCN溶液、NaOH溶液、H2O2溶液。
实验步骤 | 预期现象 |
步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 |
|
步骤二:检验Fe3+,往试管Ⅰ中,_____________ | _________________________ |
步骤三:检验Fe2+,往试管Ⅱ中,______________ | _________________________ |
(4)已知C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
A.脱水性 B.强氧化性 C.吸水性
若要验证反应产物中同时混有SO2气体和CO2气体,可选择以下试剂进行实验:
NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液
选择合适试剂,并安排合理的顺序为_____________________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有_________________离子,一定不含有_________离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程)_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下 列离子方程式书写正确的是( )
A. 氯气通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. 铁和稀硫酸反应:2Fe+6H+ = 2 Fe3++3H2↑
C. 碳酸钙与醋酸反应:CaCO3+2H+ = Ca2++CO2↑+H2O
D. 氢氧化铝和氢氧化钠溶液反应:Al(OH)3+OH- = AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
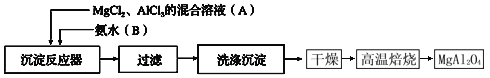
(1)写出AlCl3与氨水反应的化学反应方程式 _________________________________。
(2)判断流程中沉淀是否洗净所用的试剂是______________,高温焙烧时,用于盛放固体的仪器名称是 ________________。
Ⅱ、无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
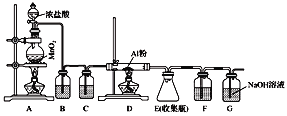
(3)其中装置A用来制备氯气,写出其离子反应方程式:______________________。
(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________。
(5)F中试剂是________。G为尾气处理装置,其中反应的化学方程式:____________________。
(6)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案_______(填“可行”,“不可行”),理由是__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com