
| A、②④⑥⑦ | B、①②③⑥ |
| C、①③④⑤⑦ | D、③④⑤⑦⑧ |


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
| A、测所得溶液的pH |
| B、取溶液少量,向其中滴入酚酞观察溶液是否变红 |
| C、取溶液少量,向其中加入盐酸观察是否有气泡产生 |
| D、取溶液少量,向其中加入CuSO4溶液,观察是否有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4L O3中含3nA个氧原子 |
| B、标准状况下,22.4L CH2Cl2含有2nA氯原子 |
| C、1mol SO2与足量的H2S充分反应,转移2nA个电子 |
| D、17g H2O2中含有9nA个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、C、D的氢化物沸点D比C高 |
| B、第一电离能A、B、C依此增大 |
| C、A、B、C中电负性最大的A |
| D、五种元素中,最高价氧化物对应的水化物酸性最强的是D |
查看答案和解析>>
科目:高中化学 来源: 题型:
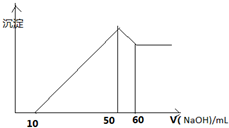 某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )
某溶液中含有H+、Al3+、Mg2+、Cu2+四种阳离子,且Mg2+ Cu2+物质的量之为1:1,逐滴加入0.1moL/L NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+、Cu2+四种阳离子的物质的量浓度之比为( )| A、1:1:1:1 |
| B、2:2:1:1 |
| C、2:1:1:1 |
| D、4:4:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定量的Cl2通入一定浓度的烧碱溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的烧碱溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A、烧碱溶液中NaOH的质量是3.6g |
| B、反应中转移电子的物质的量是0.09mol |
| C、氧化性ClO-<ClO3- |
| D、ClO3-的生成是由于温度升高引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非标准状况下,1mol任何气体的体积不可能为22.4L |
| B、常温常压下,0.2mol Na2O2与足量H2O反应,转移电子的数目为0.2NA |
| C、标准状况下,NA个水分子所占的体积为22.4L |
| D、常温常压下,0.2mol Na2O2含有0.4mol阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
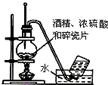 | 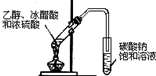 | 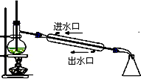 |  |
| A.实验室用乙醇制取乙烯 | B.实验室制取乙酸乙酯 | C.石油分馏 | D.实验室制取硝基苯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com