
| A、标准状况下,33.6 L SO3中含有的氧原子数是4.5NA |
| B、1 mol OH-和1 mol-OH(羟基)中含有的电子数均为9NA |
| C、在加热条件下,100 mL18.4 mol/L的浓硫酸与足量金属铜反应得到的SO2的分子数为0.92 NA |
| D、当0.2 mol Na218O2与足量CO2完全反应后,生成碳酸钠的质量为21.6 g |


科目:高中化学 来源: 题型:
| A、不溶于水的物质的溶解度为0 |
| B、H+与OH-在水溶液中混合时,反应的活化能几乎为0 |
| C、对已达平衡的可逆反应,v(正)=v(逆)=0 |
| D、常温下,1mol/L的CH3COOH溶液,pH=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B、等质量的O2比O3能量高,由O2变O3为放热反应 |
| C、O3比O2稳定,由O2变O3为吸热反应 |
| D、O2比O3稳定,由O2变O3为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.01×1020个 |
| B、6.02×1021个 |
| C、7.74×1020个 |
| D、6.67×1020个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、S2-的结构示意图: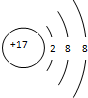 |
B、NaCl的电子式: |
| C、Cl2的结构式:Cl-Cl |
| D、NaHCO3的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
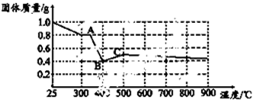 某课题组为探究淡黄色草酸亚铁晶体(FeC2O4?2H2O)的化学性质,进行了一系列实验探究.
某课题组为探究淡黄色草酸亚铁晶体(FeC2O4?2H2O)的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
取少量黑色固体, |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,则E的分子式为
,则E的分子式为 结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式
结构在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2、Cl2、HCl、酸雨 |
| B、HCl、SO2、N2、粉尘 |
| C、NH3、CO、CO2、雾 |
| D、SO2、NO2、CO、烟尘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com