
| A、离子的物质的量相等 |
| B、微粒的总的数量应相等 |
| C、正电荷和负电荷总数应相等 |
| D、电荷量和各元素原子的物质的量应相等 |


 开心蛙状元测试卷系列答案
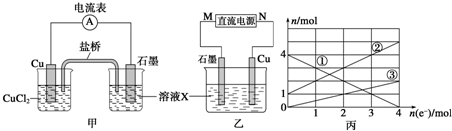
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
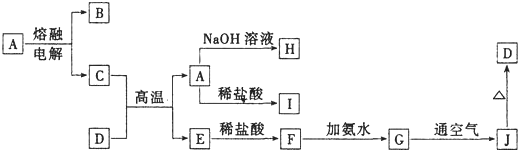
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、H+、SO42-、OH- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、Cu2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
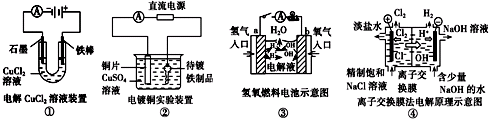
| A、装置①中阳极上析出红色固体 |
| B、装置②的待镀铁制品应与电源负极相连 |
| C、装置③中外电路电子由b极流向a极 |
| D、装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-;加入酚酞呈红色的溶液:SO42-、K+、Cl-、HSO3- 分别都不能大量共存(常温下) | ||
B、
| ||
| C、已知:25℃时,Mg(OH)2的kSP=5.61×10-12,MgF2的kSP=7.42×10-11,25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2 可以转化为MgF2 | ||
D、表示H2燃烧热的化学方程式为:H2(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、230Th的中子数比核外电子数多140 |
| B、230Th和232Th的化学性质相同 |
| C、232Th转换成233U是化学变化 |
| D、Th元素的相对原子质量是231 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用湿润的pH试纸测定两种溶液的pH时,氨水的误差更大 |
| B、若混合后溶液恰好呈中性时:c(Cl-)=c(NH4+)+c(NH3?H2O) |
| C、两溶液等体积混合时,充分反应后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、恰好反应呈中性时,所需氨水的体积大于盐酸的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 放电 |
| 充电 |
| A、电池放电时,H2是正极 |
| B、电池放电时,镍元素被氧化 |
| C、电池充电时,氢元素被还原 |
| D、电池放电时,电池负极周围溶液的pH不断增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com