
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。则相同条件下破坏1 mol NO中的化学键需要吸收的能量为________kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=________mol·L-1;往溶液中加入少量NaOH固体,则溶液中![]() ___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
(3)25℃时,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
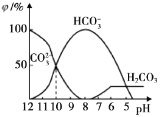
①在同一溶液中,H2CO3、HCO3-、CO32-____________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的微粒主要为___________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=___________。
HCO3-+OH-的平衡常数Kh=___________。
【答案】631.5 10-9 不变 c(CH3COO-)+c(OH-)=c(Na+)+c(H+) 不能 HCO3- 10-4
【解析】
(1)反应焓变ΔH=反应物总键能-生成物总键能;(2)酸溶液中,氢离子抑制水的电离,溶液中的氢氧根全部来自于水的电离;(3)由图分析离子存在状态,判断离子共存问题。
(1) 1 mol NO中的化学键的键能=![]() ;
;
(2)25℃时,pH=5的CH3COOH溶液中,氢氧根全部由水电离产生,且c水(H+)=c水(OH-),即由水电离出的氢离子浓度c(H+)=c水(OH-)=![]() mol·L-1;往溶液中加入少量NaOH固体, 醋酸电离常数Ka=
mol·L-1;往溶液中加入少量NaOH固体, 醋酸电离常数Ka=![]() ,温度不变,电离常数不变;混合溶液中所有离子浓度之间的等式为电荷守恒关系,c(CH3COO-)+c(OH-)=c(Na+)+c(H+)。
,温度不变,电离常数不变;混合溶液中所有离子浓度之间的等式为电荷守恒关系,c(CH3COO-)+c(OH-)=c(Na+)+c(H+)。
(3) ①由图可知,碳酸根和碳酸无法共存,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存;
②由图可知,当pH=7时,溶液中含碳元素的微粒主要为HCO3-;
③根据图像可知反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=![]() =c(OH-)=10-4。
=c(OH-)=10-4。


科目:高中化学 来源: 题型:
【题目】把![]() 气体X和
气体X和![]() 气体Y混合于2L容器中,发生反应:
气体Y混合于2L容器中,发生反应:![]()
![]()
![]() ,5分钟末已生成
,5分钟末已生成![]() ,若测知以Z浓度变化来表示的平均速率为
,若测知以Z浓度变化来表示的平均速率为![]() ,则:上述反应在5分钟末时,已用去的Y占原有量的物质的量分数是( )
,则:上述反应在5分钟末时,已用去的Y占原有量的物质的量分数是( )
A. 20% B. 25% C. 33% D. 50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳纳米管能够吸附氢气,设计一种新型二次电池,其装置如图所示。关于该电池的叙述不正确的是( )
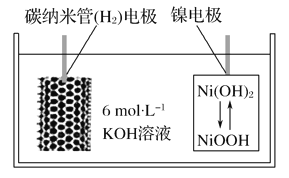
A. 电池放电时K+移向正极
B. 电池放电时负极反应为:H2-2e-+2OH-===2H2O
C. 电池充电时镍电极上NiOOH转化为Ni(OH)2
D. 电池充电时碳纳米管电极与电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠(Na2SnO3·xH2O)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,—种由锡精矿制备锡酸钠的工艺流程如下:
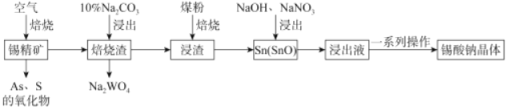
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②Na2SnO3xH2O。易溶于水,其在水中的溶解度随着温度的升高而降低。
请回答下列问题:
(1)Sn元素的原子序数为50,其在周期表中的位置为_____________。
(2)从“焙烧渣”中除去Fe3O4最简单的方法为_____________。加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO。在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___________________。
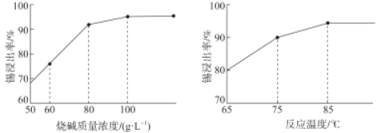
(3)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH质量浓度和反应温度间的关系图,则“碱浸”的最适宜条件为_____________、___________,
(4)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___________、洗涤、干燥。
(5)采用热重分析法测定锡酸钠晶体样品所含结晶水数,将样品加热到140℃时,失掉全部结晶水,失重约20.2%。锡酸钠晶体的化学式为__________。
(6)以纯锡为阳极材料,以NaOH和Na2SnO3为电解液,待镀金属为阴极材料,可实现在待镀金属上的持续镀锡,镀锡时阳极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中,A和B发生下列反应:A(s)+2B(g)![]() 2C(g) △H>0,在一定条件下达到平衡,若升高温度则达平衡后混合气体的
2C(g) △H>0,在一定条件下达到平衡,若升高温度则达平衡后混合气体的
A.气体的分子数减少B.A的物质的量浓度减小
C.气体的密度减小D.气体的平均相对分子质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无土栽培中需用浓度为0.5mol/L NH4Cl、0.16mol/L KCl、0.24mol/L K2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是( )
A.0.4mol、0.5mol、0.12molB.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24molD.0.64mol、0.02mol、0.24mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法不正确的是
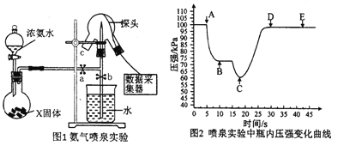
A.制取氨气时烧瓶中的固体常用CaO或NaOH
B.关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则C点时喷泉最剧烈
C.将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
D.该实验可以用来说明氨气在水中的溶解度很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g)![]() 2NH3(g)的化学平衡常数表达式为__。
2NH3(g)的化学平衡常数表达式为__。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是__。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g)+O2(g) | 5×10-31 |
② | N2(g)+3H2(g) | 4.1×106 |
(3)某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L的反应物进行合成氨反应,N2的浓度随时间的变化如图①、②、③曲线所示。
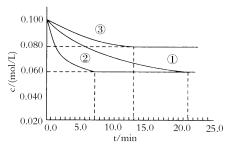
实验②平衡时H2的转化率为__。
据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:___理由:___。
③条件:___理由:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为________________________。
(2)基态Na原子中,核外电子占据的原子轨道总数为______,Te属于元素周期表中______区元素,其基态原子的价电子排布式为______________________。
(3)CO32-的空间构型为___________________,碳酸丙烯酯的结构简式如图所示,
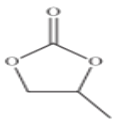
其中碳原子的杂化轨道类型为____________,1mol碳酸丙烯酯中σ键的数目为_________________。
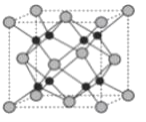
(4)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为____________,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为____________cm(用含有ρ、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com