
��ѹǿΪ2��20��104 kPa���¶ȴﵽ374��ʱ��ˮ��Ϊ�����ٽ�״̬������ʱˮ�ɽ�CO2�Ⱥ�̼������ת��Ϊ�л������ǡ�ˮ�ȷ�Ӧ�����������ڵ��¸��¸�ѹ������ͨ��ˮ�ȷ�Ӧ������ʯ�͡�ú�ȿ�����Դ������˵������ȷ���ǣ� ��
| A��������̼�볬�ٽ�ˮ�����������͵ķ�Ӧ�����ڷ��ȷ�Ӧ |
| B����ˮ�ȷ�Ӧ����һ�ָ��ӵ�������ѧ�仯 |
| C���������糧�������÷��ȣ���������̼ת��Ϊ��Դ���� |
| D�����ſƼ��Ľ�������ˮ�ȷ�Ӧ����ȡ��Դ����ʵ�ֵ�����̼��Դ�ĺ�гѭ�� |
A
�������������A�����¸�ѹ������ͨ��ˮ�ȷ�Ӧ������ʯ�͡�ú�ȿ�����Դ���������ȷ�Ӧ��A���� B��ѹǿ�ﵽ2��20��104kPa���¶ȴﵽ374��ʱ��ˮ��Ϊ�����ٽ�״̬�����ù���Ϊ�����仯����ʱˮ�ɽ�CO2 �Ⱥ�̼������ת��Ϊ�л��Ϊ��ѧ�仯����B��ȷ�� C����ѹ�����½�CO2�Ⱥ�̼������ת��Ϊ�л���ǽ�������̼ת��Ϊ��Դ���ʣ���C��ȷ��D��������õ����ϵ�̼��Դ��������̼��Դ��ѭ��ʹ�ã���D��ȷ��
���㣺��������Դ�Ŀ���������


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й��ڻ�ѧ��Ӧ��������˵����ȷ����
| A��������ķ�Ӧһ��Ϊ���ȷ�Ӧ |
| B����ѧ��Ӧһ���Ȱ��������ʱ仯�ְ����������仯 |
| C����Ӧ��Ͼɼ������յ����������������γ��¼����ų��������ķ�ӦΪ���ȷ�Ӧ |
| D����Ӧ�������е����������������������е��������ķ�ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪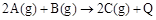 ������˵���������ȷ����
������˵���������ȷ����
| A��ʹ�ô����ɸı�÷�Ӧ�ķ�Ӧ�� |
B��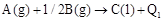 �� ��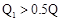 |
C��A��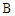 ���������ȶ��Ա�C����ǿ ���������ȶ��Ա�C����ǿ |
| D���������£�2LC����ֽ��2LA������1LB�������յ�����ΪQ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й����Ȼ�ѧ��Ӧ����������ȷ����
| A��HCl��NaOH��Ӧ���м��ȡ�H ="-57.3" kJ/mol����H2SO4��Ca(OH) 2��Ӧ�� �к��ȡ�H =2����-57.3��kJ/mol |
B��CO��g����ȼ������283.0 kJ/mol����2CO2��g�� 2CO��g��+O2��g����Ӧ 2CO��g��+O2��g����Ӧ�ġ�H =" +2��283.0" kJ/mol |
| C����Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ |
| D��1 mol����ȼ��������̬ˮ�Ͷ�����̼���ų��������Ǽ����ȼ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪1g������ȫȼ������ˮ����ʱ�ų�����121kJ����������1molO=O����ȫ����ʱ��������496 kJ��ˮ����1molH-O���γ�ʱ�ų�����463 kJ����������1molH-H������ʱ��������Ϊ
| A��920 kJ | B��557 kJ | C��436 kJ | D��188 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��
��N2(g) + 2O2(g) ="2" NO2(g) ��H = +67��7kJ/mol
��2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ��H = ��1135��7kJ/mol
����˵����ȷ����
| A��N2H4(g) + O2(g) = N2(g) + 2H2O(g)��H = ��1068 kJ/mol |
| B�������백���Ƶ������������ˮ������뷽��ʽ��N2H4 + H2O = N2H5+ + OH- |
| C�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ��ŵ�ʱ�ĸ�����Ӧʽ��N2H4��4e�� + 4OH�� = N2 + 4H2O |
| D�������缫����KOH��ҺΪ�������Һ���¡�������ȼ�ϵ�أ�����һ��ʱ���KOH��Һ��pH������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ͨ�����ǰѲ�1 molij��ѧ�������ĵ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H������ѧ��Ӧ�ġ�H���ڷ�Ӧ����ܼ�������������ܼ���֮�
| ��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
| ����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
 Si��s����4HCl��g�����÷�Ӧ�ķ�Ӧ�ȡ�HΪ�� ��
Si��s����4HCl��g�����÷�Ӧ�ķ�Ӧ�ȡ�HΪ�� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����Ȼ�ѧ����ʽ��ȷ���ǣ���H�ľ���ֵ����ȷ��( )
| A��C2H5OH(l)��3O2(g)=2CO2(g)��3H2O(g) ; ��H��-1 367.0 kJ��mol��1(ȼ����) |
| B��Ba(OH)2(aq)��2HCl(aq)=BaCl2(aq)��2H2O(l); ��H��-57.3 kJ��mol��1(���) |
| C��S(s)��O2(g)=SO2(g); ��H����269.8 kJ��mol��1(��Ӧ��) |
| D��2NO2=O2��2NO; ��H����116.2 kJ��mol��1(��Ӧ��) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com