
| A. | 0.1 mol的CaO2含阴阳离子总数是0.3NA | |
| B. | 0.1 mol苯乙烯含π键的数目为0.4NA | |
| C. | 1 L 1mol/L的Na2CO3溶液中含阴阳离子数小于3NA | |
| D. | 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
分析 A.1mol中CaO2含有1mol钙离子和1mol过氧根离子;
B.苯环中含有1个大π键,碳碳双键中含有1个π键;
C.碳酸根离子水解生成氢氧根离子和碳酸氢根离子,导致离子总数增加;
D.钠为+1价金属,2.3g钠的物质的量为0.1mol,根据电子守恒可知0.1mol钠完全反应转移了0.1mol电子.
解答 解:A.0.1 mol的CaO2含0.1mol钙离子和0.1mol过氧根离子,总共含有0.2mol离子,含有的阴阳离子总数是0.2NA,故A错误;
B.0.1 mol苯乙烯含0.1mol大π键和0.1molπ键,含有π键的总数目0.2NA,故B错误;
C.1 L 1mol/L的Na2CO3溶液中含有1mol碳酸钠,由于碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,导致离子总数增加,所以溶液中含阴阳离子数大于3NA,故C错误;
D.2.3g钠的物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,0.1mol钠与氧气完全反应,无论生成氧化钠还是过氧化钠,转移的电子都是0.1mol,转移电子数均为0.1NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确分子、原子、原子核内质子中子及核外电子的构成关系.


科目:高中化学 来源: 题型:选择题
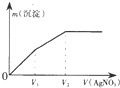 往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )| A. | $\frac{{V}_{2}-{V}_{1}}{{V}_{1}}$ | B. | $\frac{{V}_{1}}{{V}_{2}}$ | C. | $\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$ | D. | $\frac{{V}_{2}}{{V}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| C. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| D. | 工业上为了加快分离胶体中的电解质杂质,常在渗析袋外施加电场,使电解质离子透过半透膜向两极移动,该操作是应用胶体的电泳原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
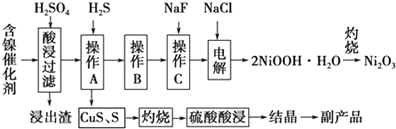
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 充电时锌极与外电源正极相连 | |
| C. | 放电时每转移3 mol电子,正极有1mol K2FeO4被还原 | |
| D. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
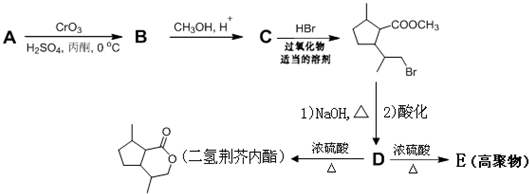
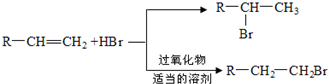
 ,D中含有的官能团的名称羧基、羟基.
,D中含有的官能团的名称羧基、羟基.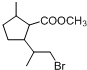 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$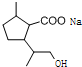 +CH3OH+NaBr.
+CH3OH+NaBr.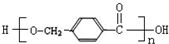 )的路线补全完整
)的路线补全完整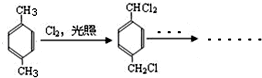
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
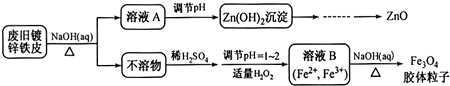
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
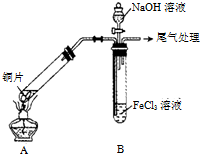 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com