
| A. | 向 0.1 mol/L CH3COOH 溶液中加入少量水,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| B. | 将 CH3COONa 溶液从 25℃升温至 40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向硝酸中加入氨水至中性,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{O}_{3}^{-})}$<1 | |
| D. | 向 AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$不变 |
分析 A.稀释促进弱电解质的电离,c(H+)减小,而Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$不变;
B.升高温度促进水解,但Ka、Kw不变,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)•c(O{H}^{-})c({H}^{+})}$=$\frac{Ka}{Kw}$;
C.向硝酸中加入氨水至中性,c(H+)=c(OH-),电荷守恒为c(NH4+)+c(H+)=c(OH-)+c(NO3-);
D.饱和溶液中加入少量 AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{c(C{l}^{-})c(A{g}^{+})}{c(B{r}^{-})c(A{g}^{+})}$=$\frac{Ksp(AgCl)}{Ksp(AgBr)}$.
解答 解:A.稀释促进弱电解质的电离,c(H+)减小,而Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$不变,则溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$增大,故A错误;
B.升高温度促进水解,但Ka、Kw不变,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)•c(O{H}^{-})c({H}^{+})}$=$\frac{Ka}{Kw}$,比值不变,故B错误;
C.向硝酸中加入氨水至中性,c(H+)=c(OH-),电荷守恒为c(NH4+)+c(H+)=c(OH-)+c(NO3-),则溶液中$\frac{c(N{H}_{4}^{+})}{c(N{O}_{3}^{-})}$=1,故C错误;
D.饱和溶液中加入少量 AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{c(C{l}^{-})c(A{g}^{+})}{c(B{r}^{-})c(A{g}^{+})}$=$\frac{Ksp(AgCl)}{Ksp(AgBr)}$,Ksp与温度有关,则比值不变,故D正确;
故选D.
点评 本题考查难溶电解质,为高频考点,把握电离平衡及溶解平衡移动、Ka及Ksp的计算为解答的关键,侧重分析与应用能力的考查,注意比值的变形,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaX |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L乙烷分子中的碳原子数目为2NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
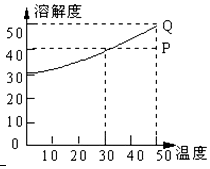 有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )
有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )| A. | 50℃时,若该盐溶液含A克溶质,保持温度不变,加入A/4 g溶质,溶液必变成饱和溶液 | |
| B. | 50℃时,140g P点溶液最少需蒸发掉20g水才能形成饱和溶液 | |
| C. | 该溶液冷却至0℃时,析出溶质10 g | |
| D. | 在保持溶质及溶剂质量不变的情况下,使P点溶液达到饱和需降温20℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OOH的物质的量 | |
| B. | 溶液中的n(H+) | |
| C. | 用同浓度的NaOH溶液恰好完全反砬,消耗NaOH溶液的体积 | |
| D. | 溶液的导电能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
| Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
| Ⅱ | 758 | 0.1 | 0.05 | 0 | |
| Ⅲ | 858 | 0.2 | 0.1 | 0 | |
| A. | 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol•L-1•s-1 | |
| B. | 平衡时,容器Ⅱ中SO3的浓度小于0.022 mol•L-1 | |
| C. | 平衡时,容器Ⅲ中SO3的浓度大于0.044 mol•L-1 | |
| D. | 若起始时,向容器Ⅰ中充入0.02 mol SO2,0.01 mol O2和0.02 mol SO3,则反应向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com