
【题目】物质氧化性、还原性的强弱,不仅与物质的结构、性质有关,还与物质的浓度和反应温度有关.下列各组物质:由于浓度不同而能发生不同氧化还原反应的是( ) ①Cu与HNO3溶液
②Cu与FeCl3溶液
③Zn与H2SO4溶液
④Fe与HCl溶液.
A.①③
B.③④
C.①②
D.①③④
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在右图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a20分钟后冷却至室温。
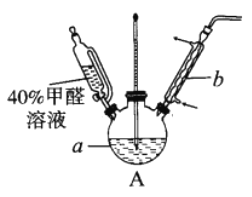
①盛装甲醛溶液的仪器名称是______________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分, 将装置A和下图中部分装置连接后进行实验。
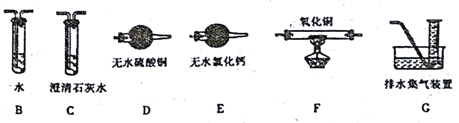
依次连接的合理顺序为A→B→____→____→____→____→G。
装置B的作用是____________。
证明有H2的实验现象是____________。
(3)反应后a中有红色固体产生,为研究其组成,进行如下实验(每步均充分反应):
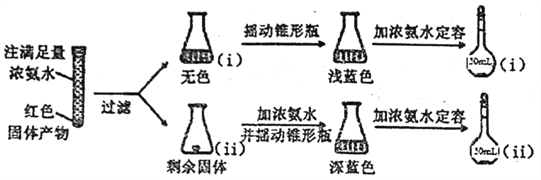
已知:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
① 锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为__________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容置瓶i相近。由此可知固体产物的组成及物质的量之比约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式___________。
(4)完成以下氧化还原反应的离子方程式:
(______)MnO4-+(______)C2O42-+______=(______)Mn2++(______)CO2↑+________。
Ⅱ.SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如图:
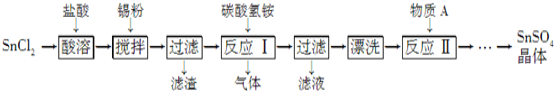
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+;SnCl2能水解生成碱式氯化亚锡。
(1)写出物质A的名称:_____。
(2)SnCl2用盐酸而不用水溶解的原因是___________(用化学方程式表示)。
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式: _________。
(4)反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:___________________。 该反应的温度需要控制在75 ℃左右的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如下图所示.以下分析正确的是
Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如下图所示.以下分析正确的是
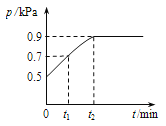
A. 从反应开始到t1时的平均反应速率v(X)=0.2/t1mol/(Lmin)
B. 该温度下此反应的平衡常数K=0.32mol/L
C. 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D. 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同。下列说法错误的是( )
A. 单质的沸点:Z>W
B. 简单离子半径:X>W
C. 元素X与氧可形成既含离子键也含非极性共价键的化合物
D. X、Y、Z的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 蔗糖、果糖和麦芽糖均为双糖
B. 商代后期铸造出工艺精湛的司母戊鼎,该鼎属于铜合金制品
C. 植物油含不饱和脂肪酸酯,能使Br/CCl4褪色
D. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com