将Na2CO3?nH2O和NaHCO3的混合物4.0g溶于水,配制成100mL溶液,向其中加入2.0mol/L盐酸至不再产生气体时,消耗盐酸20.0mL,放出气体0.672L(标准状况).试计算:
(1)原混合物中NaHCO3的质量分数.
(2)Na2CO3?nH2O中n的值.
【答案】
分析:发生反应:NaHCO
3+HCl═NaCl+CO
2↑+H
2O、Na
2CO
3+2HCl═2NaCl+CO
2↑+H
2O,
(1)令混合物中Na
2CO
3?nH
2O和NaHCO
3的物质的量分别为xmol、ymol,根据消耗的盐酸与生成的二氧化碳列方程计算x、y的值,再根据m=nM计算碳酸氢钠的质量,据此解答;
(2)根据碳酸氢钠的质量计算混合物中Na
2CO
3?nH
2O的质量,计算Na
2CO
3?nH
2O的摩尔质量,进而计算n的值.
解答:解:(1)20.0mL盐酸中HCl的物质的量为0.02L×2mol/L=0.04mol,
0.672L二氧化碳的物质的量为

=0.03mol,
令混合物中Na
2CO
3?nH
2O和NaHCO
3的物质的量分别为xmol、ymol,则:
NaHCO
3+HCl═NaCl+CO
2↑+H
2O、
xmol xmol xmol
Na
2CO
3+2HCl═2NaCl+CO
2↑+H
2O
ymol 2ymol ymol
所以
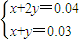
解得:x=0.02,y=0.01
所以原混合物中NaHCO
3的质量为0.02mol×84g/mol=1.68g,
所以原混合物中NaHCO
3的质量分数
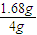
×100%=42%,
答:原混合物中NaHCO
3的质量分数42%;
(2)混合物中Na
2CO
3?nH
2O的质量为4g-1.68g=2.32g,
故Na
2CO
3?nH
2O的摩尔质量为

=232g/mol,
故n=
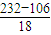
=7,
答:Na
2CO
3?nH
2O中n的值为7.
点评:本题考查混合物的有关计算,难度不大,注意基础知识的理解掌握.

 =0.03mol,
=0.03mol,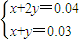
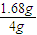 ×100%=42%,
×100%=42%, =232g/mol,
=232g/mol,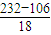 =7,
=7,
