
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
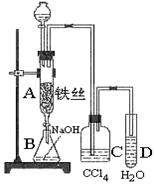 某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
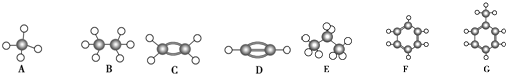
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属和非金属化合形成离子键,非金属之间只形成共价键 | |
| B. | 根据电离方程式:HCl﹦H++Cl-,可判断HCl分子里存在离子键 | |
| C. | 干冰气化时破坏分子中的共价键 | |
| D. | 有机化合物分子中的碳原子不仅以共价键形成碳链,也能形成碳环 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥ | B. | ②③ | C. | ①④ | D. | ⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com