
����Ŀ����֪��
��.A��ʯ���ѽ�������Ҫ�ɷ֣�A�IJ���ͨ���Ǻ���һ������ʯ�ͻ���ˮƽ�ı���
��.2CH3CHO��O2��2CH3COOH��
����AΪ��Ҫԭ�Ϻϳ�������������ϳ�·����ͼ��ʾ��

��ش��������⡣
(1)д��A�Ľṹ��ʽ��___��
(2)B���ʵ�������___��
(3)E___(��ܻ��ܡ�)ʹ���Ը��������Һ��ɫ
(4)д�����з�Ӧ����ʽ����Ӧ���ͣ�
�ڻ�ѧ����ʽ__����Ӧ����___��
�ܻ�ѧ����ʽ__����Ӧ����___��
���𰸡�CH2=CH2 �Ҵ� ���� 2CH3CH2OH+O2![]() 2CH3CHO+2H2O ������Ӧ CH3CH2OH+CH3COOH
2CH3CHO+2H2O ������Ӧ CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O ������Ӧ��ȡ����Ӧ
CH3COOC2H5+H2O ������Ӧ��ȡ����Ӧ
��������
A��ʯ���ѽ�������Ҫ�ɷ֣�A�IJ���ͨ������һ�����ҵ�ʯ�ͻ���ˮƽ����AӦΪ��ϩCH2=CH2����ϩ��ˮ��һ�������·����ӳɷ�Ӧ����CH3CH2OH���Ҵ���Cu��Ag�����������·���������ӦCH3CHO��CH3CHO�ɽ�һ������ΪCH3COOH��CH3CH2OH��CH3COOH��Ũ���������·�Ӧ��������������������ϩ�к���C=C����һ�������·����Ӿ۷�Ӧ����E����ϩ����AΪCH2=CH2��BΪCH3CH2OH��CΪCH3CHO��DΪCH3COOH��EΪ����ϩ���ݴ˻ش�
(1)���ݷ�����AΪ��ϩ���ṹ��ʽΪ��CH2=CH2��
(2) BΪCH3CH2OH���������Ҵ���
(3)E�Ǿ���ϩ![]() ���ṹ�в���̼̼˫�������Բ���ʹ���Ը��������Һ��ɫ��
���ṹ�в���̼̼˫�������Բ���ʹ���Ը��������Һ��ɫ��
(4)��Ϊ�Ҵ���Cu��Ag�����������·���������Ӧ����CH3CHO����ѧ����ʽΪ2CH3CH2OH+O2![]() 2CH3CHO+2H2O����Ӧ����Ϊ������Ӧ��
2CH3CHO+2H2O����Ӧ����Ϊ������Ӧ��
��ΪCH3CH2OH��CH3COOH��Ũ���������·�Ӧ����������������ѧ����ʽCH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O����Ӧ����Ϊ������Ӧ��ȡ����Ӧ��
CH3COOC2H5+H2O����Ӧ����Ϊ������Ӧ��ȡ����Ӧ��


 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�ķ���ʽ��ȷ����
A.����Ȼ�þ��Һ��2Cl�C+2H2O![]() H2��+Cl2��+2OH�C
H2��+Cl2��+2OH�C
B.̼�������Һ�м�������ʯ��ˮ��Ca2++![]() +OH�C=CaCO3��+H2O
+OH�C=CaCO3��+H2O
C.Al2(SO4)3��Һ�м��������ˮ��Al3++3NH3��H2O=Al(OH)3��+3NH4+
D.����������Һ�м���ϡ���H��(aq)��OH��(aq)=H2O(l)����H����57.3 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NiCl2�ǻ����ϳ�������Ҫ����Դ����ҵ�����ú���(Ni)�ϴ�������Ҫ����Ni��������SiO2��Al2O3��Fe�������������ᡢ������ʣ������Ȼ������壨NiCl2��nH2O��������ͼ��
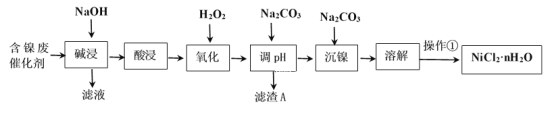
���ֽ�����������Ksp����ֵ���±���ʾ��
��ѧʽ | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp����ֵ | 10-17 | 10-38 | 10-34 | 10-15 |
�ش��������⣺
��1��Al��ԭ�ӽṹʾ��ͼΪ___��
��2��������������ܽ�����ʹ�õ���Ϊ___���������ʱ������Ӧ�����ӷ���ʽΪSiO2+2OH-=SiO32-+H2O��____��
��3��������������H2O2��Һ����������___(�����ӷ���ʽ��ʾ)��Ȼ�����pHʹ��Һ����Ԫ��ǡ����ȫ����������Ũ����10-5mol��L-1ʱ�����ӳ�����ȫ������ʱ�����µ�pHԼΪ____��
��4��������������ʵ���������Ϊ�������ȣ�Ũ����___Ϊֹ����ȴ�ᾧ�����ˡ�ϴ�ӡ�������ò�Ʒ��
��5���������ѳ�Ϊ��϶�����������Ҫ������ͣ����ڼ��Ե������Һ�Ĺ���ԭ�����£�M+Ni(OH)2![]() MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��
MH+NiOOH(ʽ��MΪ����Ͻ�)��д����س������������ĵ缫��Ӧʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ƹ�Ѫѹ��ҩ����м��壬����ͨ�����·����ϳɣ�

��ش��������⣺
��1��д��C�еĹ����ŵ�����Ϊ_________________.
��2����������ķ���ʽ________________.
��3��д����Ӧ�ٵĻ�ѧ����ʽ__________________________________________����Ӧ�ڵķ�Ӧ������_____________
��4����Ӧ���м�����Լ�X�ķ���ʽΪC3H5OCl��X�Ľṹ��ʽΪ____________________.
��5����������������B��ͬ���칹������_______�֣����к˴Ź������������ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ3��2��2��1��1��1����________________________(д�ṹ��ʽ)
���ܷ���������Ӧ�����ܷ���ˮ��
������FeCl3��Һ������ɫ��Ӧ
��ֻ��һ����
��6����������֪ʶ�������Ŀ���������Ϣ��д����![]() ��
�� Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·������ͼ(���Լ���ѡ)���ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ(���Լ���ѡ)���ϳ�·������ͼʾ�����£�![]() _______________________
_______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ������í������������ʴԭ����ͼ��ʾ�������й�˵���У�����ȷ����( )
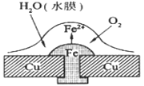
A. �˹�����ͭ��������ʴ
B. �˹����������缫��ӦʽΪ��2H++2e- = H2��
C. �˹����е��Ӵ�Fe����Cu
D. �˹����л��漰����Ӧ��4Fe(OH)2+2H2O+O2=4Fe(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ﶬ���������߷��ļ��ڣ���������β����ȼúβ���������������Ҫԭ��֮һ��
��1����ҵ�����ü������ԭNO���ɼ��ٵ���������ŷš�
��֪��CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)��H=-574kJ��mol1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)��H=-1160kJ��mol1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ_____________________________________��
��2������β���������ǿ�������β���ŷš���������β����Ⱦ������Ч���ֶΣ���Ҫԭ��Ϊ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��H<0
N2(g)+2CO2(g)��H<0
T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ����(0��15min)��NO�����ʵ�����ʱ��仯����ͼ��ʾ��
����֪��ƽ��ʱ����ķ�ѹ������������������ϵ����ѹǿ��T��ʱ�ﵽƽ�⣬��ʱ��ϵ����ѹǿΪp=20MPa����T��ʱ�÷�Ӧ��ѹ��ƽ�ⳣ��Kp��_______��ƽ����������¶Ȳ��䣬���������г���NO��CO2��0.3mol��ƽ�⽫_____(����������ҡ�����)�ƶ���
��15minʱ�����ı���練Ӧ����������n(NO)������ͼ��ʾ�ı仯����ı������������__(�����)
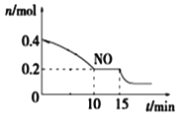
A.����COŨ��B.����C.��С�������D.�������
��3����ҵ�ϳ�����������Һ�������ķ�����ͬʱ����SO2���͵�������������(NOx)����������������Һ���տɵõ�Na2SO3��NaHSO3��NaNO2��NaNO3����Һ����֪�������£�HNO2�ĵ��볣��ΪKa=7��10-4��H2SO3�ĵ��볣��ΪKa1=1.2��10-2��Ka2=5.8��10-8��
�ٳ����£���ͬŨ�ȵ�Na2SO3��NaNO2��Һ��pH�ϴ����______��Һ��
�ڳ����£�NaHSO3��___��(�������������������������жϵ�������(ͨ������˵��)_____________��
��4����Ԫ��(Ce)����ϵ��������Ȼ�����ߵ�һ�֣�������+3��+4���ּ�̬�������к��д�������Ⱦ��NO�����Ա���Ce4+����Һ���գ�����NO2-��NO3-���������ʵ���֮��Ϊ1��1)���ɲ��õ�ⷨ����������Һ�е�NO2-ת��Ϊ�����ʣ�ͬʱ����Ce4+����ԭ����ͼ��ʾ��
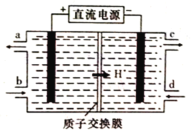
��Ce4+�ӵ��۵�_____(����ĸ����)��������
��д�������ĵ缫��Ӧʽ��_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��һ����Ũ���ᷴӦ���õ�����ͭ��Һ��NO��NO2�Ļ�����壬��Щ������1.68LO2(��״����)��Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᡣ������������ͭ��Һ�м���5mol/LNaOH��Һ��Cu2+ǡ����ȫ��������������ҺNaOH�������( )
A.60mLB.45mLC.30mLD.15mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ѫ֬����Ӱ������ɿ���������H��һ���ٴ����Ƹ�Ѫ֢֬��ҩ�H�Ľṹ��ʽ��ͼ��ʾ��
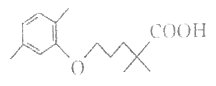
����˵������ȷ���ǣ� ��
A. �л���H���еĹ�����ֻ���Ȼ�
B. 1mol H��ȫȼ������19molO2
C. �л���H�Ƿ��㻯����
D. �л���H�ܺ��ơ�̼�����Ʒ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڸ��������µ�ͬ���칹����Ŀ��ȷ����
A.C4H10����������ͬ���칹����3��
B.���������C5H10O2���������ͬ���칹����5��
C.���������C5H10O����ȩ��ͬ���칹����3��
D.![]() ��һ�������5��
��һ�������5��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com