
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作:
xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4 ②(NH4)2S ③NaOH ④ KSCN
(2)氧化剂可选用_________。①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
【答案】(18分)(1)①(2分) (2)①④(2分) (3)③④(2分) (4)②③①(2分)
(5)250ml容量瓶(2分);b(2分) (6)二(2分);晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解(2分);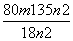 (2分)
(2分)
【解析】
(6)由于氯化铜是强酸弱碱盐,铜离子易水解生成氢氧化铜与氯化氢,水解吸热,且生成的氯化氢具有挥发,所以晶体灼烧时,结晶水失去时,会形成溶液,促进CuCl2水解,因此方案一是错误的,方案二正确。n2g固体是氧化铜,物质的量是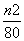 mol,则根据铜原子守恒可知氯化铜晶体的物质的量是
mol,则根据铜原子守恒可知氯化铜晶体的物质的量是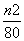 mol,则
mol,则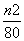 mol×(135+18x)g/mol=mg,解得x=
mol×(135+18x)g/mol=mg,解得x=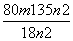 。
。
考点:考查晶体制备、结晶水含量测定、离子检验、物质的分离与提纯、一定物质的量浓度的配制以及滴定实验


科目:高中化学 来源: 题型:
下列8种有机物
①CH2=CH2;② ;③
;③ ;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦
;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦ ;⑧CH3CH2OH.根据官能团的不同,有机物可分为
;⑧CH3CH2OH.根据官能团的不同,有机物可分为
A.4类 B.5类 C.6类 D.7类
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y为短周期元素,X位于第IA族,X与Y可形成化合物X2Y,下列说法不正确的是
A.两元素还可能形成原子个数比为1:1的化合物
B.X与Y的简单离子可能具有相同电子层结构
C. X的原子半径一定大于Y的原子半径
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式书写及对应表述均正确的是
A.密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。则
Fe(s)+S(s)=FeS(s) △H=-95.6kJ/mol
B.稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
C.已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:
2H2O(l)=2H2(g)+O2(g) △H=+285.5kJ/mol
D.已知2C(s)+O2 (g)=2CO(g) △H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作完全正确的是
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000ml | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
A.Fe(NO3)x中的x为2
B.磁性氧化铁中的铁元素全部被氧化
C.稀HNO3在反应中只作氧化剂
D.反应中每生成0.4 mol还原产物,就有1.2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
第三周期五种元素A、B、C、D、E,A和B的最高价氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物的水溶液呈酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是( )
A. CDEAB B. ECDAB C. BAEDC D. BADCE
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com