
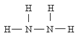 )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.分析 (1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)依据盖斯定律:②×2-①得到:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g),反应热与化学计量数成正比;
(3)反应中焓变等于反应物中键能之和-生成物中键能之和;
(4)NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,同时生成氯化钠与水.
解答 解:(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律写出肼和N2O4反应的热化学方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
(3)设断裂1molN-H键所需的能量为x,
由反应及焓变等于反应物中键能之和-生成物中键能之和可知,
4x+154+498-942-2×2×464=-534,
解得x=403(kJ),
故答案为:403;
(4)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O.
点评 本题考查了氧化还原反应、盖斯定律的应用、燃料电池中电极反应式书写等知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 组成元素相同,各元素质量分数也相同的不同物质属于同系物 | |
| B. | 分子式相同的不同物质一定是同分异构体 | |
| C. | 相对分子质量相同的不同物质一定是同分异构体 | |
| D. | 通式相同的不同物质一定属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡 时数 据 | 反应能量变化的绝对值(kJ) | a | b | c |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
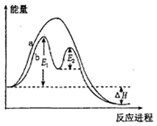
| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为吸热反应 | |
| C. | 改变催化剂,可改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
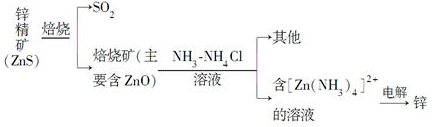
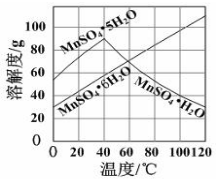
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(H2)=0.1 mol•L-1•min-1 | B. | υ(N2)=0.2 mol•L-1•min-1 | ||
| C. | υ(NH3)=0.15 mol•L-1•min-1 | D. | υ(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com