
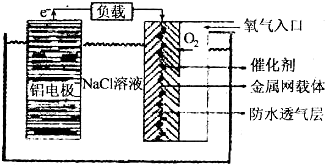
 .
.分析 (1)根据铝的电子层数和最外层电子数确定其在周期表中的位置;
(2)①铝和氧气、水能反应生成氢氧化铝;
②溶液中自由移动的离子浓度越大,溶液的导电性越强;
③阳极上失电子发生氧化反应;
④先根据氢氧化钠的物质的量计算电解时转移电子的物质的量,再根据原电池中电池的效率计算原电池中转移电子的物质的量,最后根据转移电子的物质的量计算消耗的铝的质量;
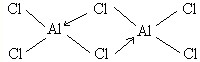
(3)①根据氯化铝的结构特点结合题意写出结构式;
②根据反应物、生成物和反应条件写出反应方程式.
解答 解:(1)铝原子原子核外有3个电子层,最外层上有3个电子,所以其在周期表中的位置是第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)①铝和氧气、水能反应生成氢氧化铝,反应方程式为:4Al+3O2+6H2O=4Al(OH)3,故答案为:4Al+3O2+6H2O=4Al(OH)3;
②溶液中自由移动的离子浓度越大,溶液的导电性越强,水是弱电解质导电能力较小,为增大水的导电性,所以加入氯化钠,故答案为:增强溶液的导电能力;
③阳极上失电子发生氧化反应,所以电解碘化钾溶液时,阳极上碘离子放电和水反应生成碘酸根离子和氢离子,电极反应式为:I-+3H2O-6e-=IO3-+6H+,
故答案为:I-+3H2O-6e-=IO3-+6H+;
④电解氯化钠溶液后,氢氧化钠的物质的量=0.3mol/L×0.5L=0.15mol,设电解过程中电子转移的物质的量是x,
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ 转移电子
2mol 2mol
0.15mol x
x=0.15mol
某铝一空气电池的效率为50%,所以原电池中转移电子的物质的量是0.3mol,设消耗铝的质量为y.
Al-3e-=Al3+
27g 3mol
y 0.3mol
y=2.7g
故答案为:2.7g;
(3)①氯化铝为共价化合物,氯原子提供孤对对子,铝原子提供空轨道,形成配位键,使所有原子均达到8电子稳定结构,所以结构式为 ,故答案为:
,故答案为: ;
;
②根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为:Al2O3+3C+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO,
故答案为:Al2O3+3C+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3CO.
点评 本题考查了结构式、电极反应式、化学反应方程式的书写、物质的量的有关计算等知识点,注意氯化铝结构式的书写,为易错点,该结构式中存在配位键导致容易写错.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•L-1•s-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=0.8mol•L-1•s-1 | D. | v( D )=1.0mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度0C化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (要求写出反应条件).
(要求写出反应条件). (要求写出反应条件).
(要求写出反应条件). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com